Eis ist nicht gleich Eis
Franziska Konitzer

Wasser gefriert zu Eis. Man kann damit Getränke kühlen oder darauf Schlittschuhlaufen. Doch das uns so vertraute Eis ist tatsächlich nur eine Variante des gefrorenen Wassers. Derzeit kennen Wissenschaftler rund zwanzig weitere Arten von Eis. Klar ist: Das H2O-Molekül hält noch die eine oder andere Überraschung bereit.
Wasser spielt eine zentrale Rolle auf unserem Planeten: Es füllt die Ozeane, wir selbst bestehen zu über fünfzig Prozent aus Wasser und verdursten bei Wassermangel innerhalb kürzester Zeit. Wie auch andere Stoffe kann es in verschiedenen Aggregatzuständen vorliegen. Doch die H2O-Moleküle, zusammengesetzt jeweils aus einem Sauerstoffatom und zwei Wasserstoffatomen, zeigen einige außergewöhnliche Eigenschaften. Das prominenteste Beispiel dafür dürfte seine verringerte Dichte im gefrorenen Zustand sein. Diese sorgt beispielsweise dafür, dass Eiswürfel auf flüssigem Wasser schwimmen. Doch Eis ist nicht gleich Eis. „Man kann gar keine eindeutige Definition geben“, sagt Christoph Salzmann vom britischen University College London. „Das liegt daran, dass Wasser – oder genauer gesagt Eis – so ein vielschichtiges Material ist.“
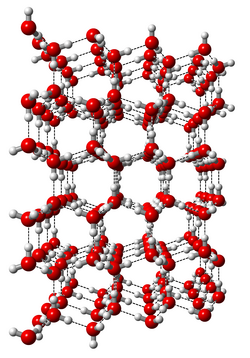
Haushaltsübliche Eiswürfel oder Schneeflocken zählen beispielsweise zum sogenannten Eis I, auch bekannt als Eis Ih. Das „h“ steht dabei für hexagonal, denn auf mikroskopischer Ebene sind die Moleküle hexagonal angeordnet. Die Sauerstoffatome befinden sich jeweils an den Ecken eines Sechsecks und sind über Wasserstoffbrücken mit den anderen Wassermolekülen verbunden. Jedes Wassermolekül kann insgesamt vier solcher Wasserstoffbrücken ausbilden und sich auf sechs verschiedene Weisen im Raum anordnen.
Zwar ist im Alltag oft die Rede von Eiskristallen, doch: „Das normale Eis I ist genau genommen überhaupt kein Kristall“, so Salzmann. Als typisches Merkmal für einen Kristall gilt, dass seine Bestandteile auf mikroskopischer Ebene wie auf einem Gitter angeordnet sind – und das regelmäßig. Jedes Atom hat also seinen festen Platz. Bei hexagonalem Eis ist das allerdings nur für die Sauerstoffatome der Fall. „Die Wasserstoffatome sind nicht periodisch angeordnet“, erläutert Salzmann. „Sie sind zufällig verteilt, das ganze Wassermolekül dreht sich sozusagen auf seinem Gitterplatz.“
Eis Ih ist uns deshalb so vertraut und allgegenwärtig, weil es sich bei Atmosphärendruck und unter Null Grad Celsius bildet – etwa im Eisfach oder in den Wolken. „Dieses hexagonale Stapelrezept kann man sich so vorstellen, dass man eine Schicht von Eiskristallen nimmt und das Spiegelbild oben draufpackt“, erklärt Salzmann. „Es gibt aber auch das kubische Stapelrezept, bei dem man die ganze Schicht bezüglich der darunterliegenden Schicht verschiebt.“ Das sogenannte Eis Ic – „c“ steht für das englische Wort cubic, also kubisch – kann sich bei Temperaturen von unter minus 22 Grad Celsius bilden.
„Bis vor Kurzem hat man angenommen, dass es Eis gibt, das zu hundert Prozent hexagonale oder kubische Stapelfolgen aufweist“, berichtet Salzmann. „Aber wenn man im Labor versucht, kubisches Eis herzustellen, ist das immer mit hexagonalen Stapelfolgen gemischt.“ Der Rekord liegt derzeit bei einem Anteil von 73 Prozent kubischem Eis, aufgestellt von Salzmann und seinen Kollegen. Ihr Trick ist dabei, kleine Wassertropfen sehr schnell abzukühlen. Auch künftig wollen die Wissenschaftler versuchen, rein kubisches Eis herzustellen. „Das wäre dann der perfekte Eiswürfel“, so der Forscher.
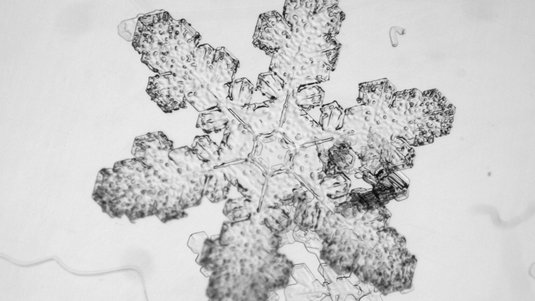
Prinzipiell herrschen auch in der Erdatmosphäre jene Bedingungen, die das Eis mit gemischten Stapelfolgen zur Entstehung benötigt. Deshalb ist es durchaus möglich, dass sich dort nicht nur hexagonales, sondern auch das stapelungeordnete Eis bildet. Einen Hinweis darauf liefern Berichte und Beobachtungen von Schneeflocken, die statt der üblichen sechsfachen Symmetrie nur eine dreifache Symmetrie aufweisen. Zwar lässt sich die innere Struktur von Eis mithilfe von Röntgenstrahlen untersuchen, die aufgrund der regelmäßigen Anordnung der Atome auf charakteristische Art und Weise gebeugt werden. Derartige Analysen sind aber nicht vor Ort in den Wolken möglich. Somit liefern die Schneeflocken mit dreifacher Symmetrie zwar ein Indiz, ein definitiver Nachweis steht derzeit aber noch aus. „Aber im Prinzip müsste das einfach in unserer Atmosphäre existieren“, sagt Salzmann.
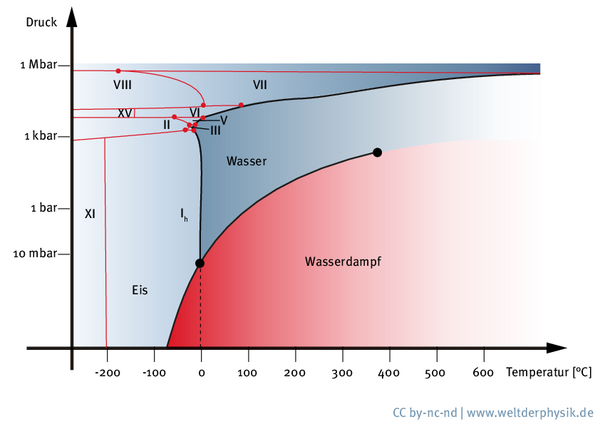
Neben Eis I – ob nun kubisch oder hexagonal angeordnet – hat das Phasendiagramm von Wasser noch zahlreiche weitere Eisvarianten mit unterschiedlichen Strukturen und Eigenschaften zu bieten: Derzeit kennen Forscher 17 verschiedene kristalline Formen von Eis, die sich abhängig von Druck und Temperatur ausbilden. „Und das sind komplett unterschiedliche Materialien“, so Salzmann. Diese starke Verschiedenheit der Phasen, die doch alle aus den gleichen Grundbausteinen hervorgehen, wird besonders eindrücklich bei Graphit und Diamanten. Sowohl die Bleistiftmine als auch der Edelstein bestehen aus reinem Kohlenstoff, könnten aber unterschiedlicher nicht sein – nicht nur was den Preis betrifft. Entscheidend ist die innere Struktur: Während ein Diamant genau wie Eis Ic eine kubische Kristallstruktur aufweist, ähnelt Graphit in seinem Aufbau einer gewöhnlichen Schneeflocke, denn seine Kristallstruktur ist hexagonal.
Neben dem unterschiedlichen mikroskopischen Aufbau unterscheiden sich die verschiedenen Formen von Eis vor allem durch ihre Dichte. „Wenn man zu höheren Drücken geht, unter denen es hergestellt wird, bekommt man viel dichtere Materialien“, erläutert Salzmann. „Aber auch was die Härte, den Schmelzpunkt oder die Kristallstruktur betrifft, gibt es große Unterschiede.“ Die kristallinen Phasen von Eis lassen sich zudem in wasserstoffgeordnete und wasserstoffungeordnete Formen unterteilen – je nachdem, ob die Wasserstoffatome fest im Kristallgitter angeordnet sind oder eben nicht. „Es gibt immer Paare von Eis. So ist Eis XIII das wasserstoffgeordnete Gegenstück zu Eis V, und Eis XV das Gegenstück zum wasserstoffgeordneten Eis VI“, erklärt Salzmann. Die wasserstoffgeordneten Formen Eis XIII, Eis XIV und Eis XV wurden von dem Wissenschaftler und seinen Kollegen entdeckt. Das gelang ihnen nur, indem sie dem Eis winzige Mengen an Salzsäure zufügten. Die Salzsäure half den Wasserstoffatomen, sich regelmäßig anzuordnen, bevor sie auf ihren Plätzen im Gitter einfroren. Für Eis IV ließ sich die wasserstoffgeordnete Phase bislang noch nicht aufspüren.
Während Eis I überall auf dieser Welt zu finden ist, existieren die anderen Phasen von Eis bislang ausschließlich im Labor. Eine Ausnahme bildet nur Eis VI, das man innerhalb von Diamanten nachweisen konnte. Künstlich lassen sich die verschiedenen Eisformen mithilfe von hydraulischen Pressen und Stempeln erzeugen – aber auch diese stoßen irgendwann an ihre Grenzen. „Eis VIII ist die dichteste Eisform“, sagt Salzmann. Prinzipiell lässt es sich aus Eis VII bei Temperaturen von unter fünf Grad Celsius herstellen. Allerdings: „Für die Herstellung brauchen wir einen Druck von 25 000 Atmosphären. Den können wir zwar einmal erzeugen, aber danach ist unsere Ausrüstung kaputt“, so der Wissenschaftler.
Jenseits der Erde wäre es jedoch durchaus möglich, dass exotische Eisformen natürlich vorkommen. Eismonde wie etwa Ganymed um Jupiter besitzen bis zu 600 Kilometer dicke Eisschichten, die trotz der geringeren Schwerkraft des Himmelskörpers einen enormen Druck erzeugen. Auch im restlichen Weltall ist Wasser in Form von Eis recht häufig vertreten – schließlich ist H2O das dritthäufigste Molekül im Universum. Es bildet sich auf Kometen oder kleinen Staubkörnern, weist dann allerdings eine amorphe, also ungeordnete Struktur auf. Bislang kennen Forscher mindestens zwei verschiedene amorphe Formen von Eis. Doch selbst mit 17 kristallinen und zwei amorphen Formen scheint das Phasendiagramm von Eis noch längst nicht vollständig. Das meint auch Christoph Salzmann: „Da ist noch kein Ende in Sicht“.
Quelle: https://www.weltderphysik.de/thema/hinter-den-dingen/eis-ist-nicht-gleich-eis/