„Jedes Verfahren besitzt Vor- und Nachteile“
Dirk Eidemüller

DESY/Heiner Müller-Elsner
Weltweit sind Forscher auf der Suche nach einem Wirkstoff gegen das Coronavirus SARS-CoV-2. Um die Medikamentensuche zu erleichtern, versuchen die Wissenschaftler, die Proteinstruktur des Virus mithilfe verschiedener Methoden zu entschlüsseln. Welche Verfahren sich dafür eignen, erläutert Dieter Willbold von der Universität Düsseldorf und dem Forschungszentrum Jülich im Interview mit Welt der Physik.
Welt der Physik: Welches sind die wichtigsten Verfahren, um Proteine von Viren wie COVID-19 zu entschlüsseln?
Dieter Willbold: Wenn man den dreidimensionalen Aufbau mikroskopischer Strukturen – und insbesondere von biologischer Materie – verstehen will, kommen vor allem drei experimentelle Methoden infrage. Das sind erstens die Röntgenkristallografie, zweitens die Kryo-Elektronenmikroskopie und drittens die Kernresonanzspektroskopie. Jedes dieser Verfahren besitzt seine eigenen Vor- und Nachteile. Das Gute ist aber, dass wir diese Verfahren auch miteinander kombinieren können und dadurch ein detaillierteres Bild erhalten, als es jeweils nur eine einzelne Technik liefern könnte. Daneben gibt es aber auch die Neutronenspektroskopie und – immer stärker werdend – die rein computerbasierten Simulationsmethoden.
Was sind Stärken und Schwächen der Röntgenkristallografie?
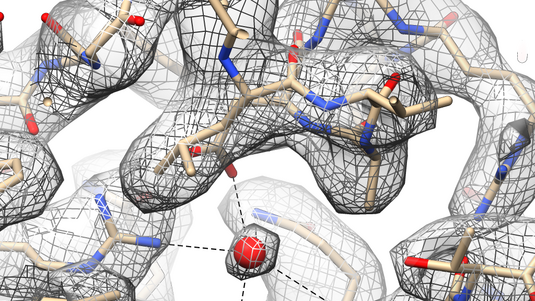
Diese Technik ist so etwas wie das alterprobte Arbeitspferd der Proteinforschung. Wenn man Proteine von Zellen – oder eben auch von Viren – mit dieser Methode untersucht, ermöglicht das eine sehr hohe Auflösung: Aus den Röntgenbeugungsbildern kann man meist mit atomgenauer Präzision ein dreidimensionales Bild dieses Proteins errechnen. Der Nachteil liegt allerdings darin, dass diese Methode nur bei solchen Proteinen möglich ist, die sich kristallisieren lassen. Vor allem bei sehr großen Proteinkomplexen ist das häufig ein Problem. Außerdem kann es sein, dass sich kristallisierte Proteine in ihrer Form etwas davon unterscheiden, wie sie in einer Lösung aussehen. Wie die Erfahrung in der Vergangenheit aber gezeigt hat, ist das nur selten ein Problem.
Woher stammen die notwendigen Röntgenstrahlen?
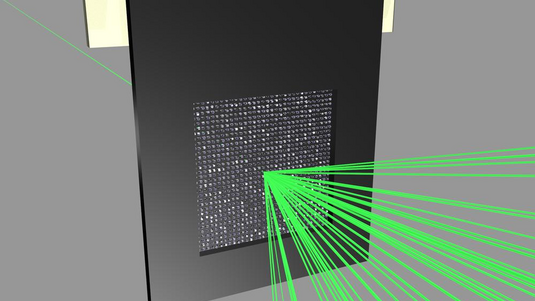
Für solche Untersuchungen benötigt man extrem starkes und scharf gebündeltes Röntgenlicht. Das kommt nicht aus herkömmlichen Röntgenquellen, sondern aus speziellen Teilchenbeschleunigern, den sogenannten Synchrotronen. Wir nutzen dafür etwa den Elektronenspeicherring PETRA III am Forschungszentrum DESY in Hamburg.
Wie sieht es mit der Kryo-Elektronenmikroskopie aus?
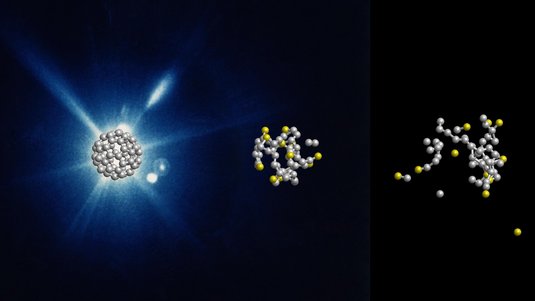
Die normale Elektronenmikroskopie funktioniert nicht gut mit biologischer Materie. Das liegt unter anderem daran, dass die intensiven Elektronenstrahlen die Zellen, Proteine oder Viren so schnell beschädigen, dass man kein brauchbares Bild aufnehmen kann. Deshalb hat sich vor einigen Jahren die Kryo-Elektronenmikroskopie etabliert. Wenn man etwa Proteine in einem Schockfrostverfahren einfriert, behalten sie ihre natürliche Form, sind aber durch die tiefen Temperaturen fest im ebenfalls tiefgefrorenen Lösungsmittel eingeschlossen. So werden Schäden durch die Elektronenstrahlen abgemildert. Bei der sogenannten Einzelpartikel-Kryo-Elektronenmikroskopie erhält man von einer Probe viele Hundert Bilder. Dabei ist das Protein jeweils aus vielen verschiedenen Ansichten abgebildet. Aus diesen Bildern erstellt dann ein Computeralgorithmus ein möglichst atomar aufgelöstes dreidimensionales Modell.
Was sind die Vor- und Nachteile dieser Technik?
Der Vorteil liegt einerseits darin, dass man ein solches Kryo-Elektronenmikroskop im Prinzip an jeder Universität installieren kann und keinen Teilchenbeschleuniger braucht wie bei der Röntgenkristallografie. Man muss auch keine Kristalle züchten, was sich ja manchmal als schwierig bis unmöglich erweist. Außerdem kann man die Proteine in ihrer natürlichen Umgebung betrachten. Allerdings braucht es derzeit noch deutlich längere Messzeiten als bei der Röntgenkristallografie und die Bilder sind oftmals etwas weniger präzise.
Wie funktioniert die dritte Methode?
Ähnlich wie bei der medizinischen Kernresonanzspektroskopie untersucht man die Radiowellen, die von den Kernen bestimmter Atome ausgesandt werden, wenn man sie in einem extrem starken Magnetfeld anregt. Mit einem Kernresonanztomografen – wie er an Kliniken steht – lassen sich die großräumigen Strukturen im menschlichen Gewebe auf nichtinvasive Weise abbilden. Dagegen möchte man bei der Strukturaufklärung von Proteinen mittels Kernresonanzspektroskopie die Positionen aller Atome im untersuchten Protein bestimmen. Dafür nutzen wir aus, dass Wasserstoffatome nicht immer genau die gleichen Radiowellen aussenden, sondern sich ihre Resonanzfrequenz ganz leicht unterscheidet – je nachdem in welcher Umgebung sie sich befinden. Wenn wir auf diese Weise ein Protein analysieren, kann man ebenfalls aus den Daten ein atomar aufgelöstes 3D-Modell erstellen.
Wie lassen sich diese Verfahren am besten kombinieren?
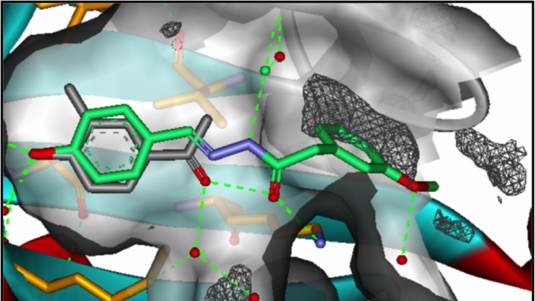
Wenn man etwa ein besonders großes und komplexes Molekül untersuchen will – das sich schlecht kristallisieren lässt –, können wir uns zunächst mithilfe der Kryo-Elektronenmikroskopie ein erstes Gesamtbild machen. Besonders interessante Unterbereiche – die sich beispielsweise für die Medikamentenforschung anbieten – werden dann mit der Röntgenkristallografie genauer untersucht. Auch die Kernresonanzspektroskopie liefert zusätzliche Informationen, etwa über besonders bewegliche Teile des untersuchten Proteins, die sich mit der Röntgenkristallografie gar nicht untersuchen lassen. Auf diese Weise erhalten wir dann einen guten Überblick über ein Protein.
Quelle: https://www.weltderphysik.de/gebiet/leben/jedes-verfahren-besitzt-vor-und-nachteile/