Zerberstendes Biomolekül im Röntgenlaser
Redaktion
DESY/Zoltan Jurek
Ein internationales Forschungsteam hat in Echtzeit verfolgt, wie sogenannte Buckminster-Fullerene im Strahl eines Röntgenlasers zerplatzen. Diese kugelförmigen Moleküle bestehen aus sechzig Kohlenstoffatomen, die abwechselnd in Fünf- und Sechsecken angeordnet sind. Zwar dauerte es weniger als eine billionstel Sekunde, bis sich das Molekül auflöste – dennoch läuft dieser Vorgang langsamer und auch etwas anders ab als erwartet, so die Wissenschaftler im Fachblatt „Nature Physics“. Relevant seien die Ergebnisse vor allem für die Analyse empfindlicher Proteine und anderer Biomoleküle mithilfe von Röntgenlasern.
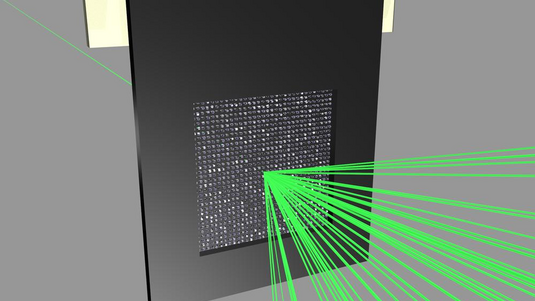
Das Team um Nora Berrah von der University of Connecticut in den USA beschoss einzelne Kohlenstoff-60-Moleküle mit dem Strahl der Linac Coherent Light Source am Forschungszentrum SLAC in Kalifornien. Die jeweils nur etwa zwanzig Femtosekunden dauernden Röntgenblitze schlagen aus etwa jedem fünften der sechzig Kohlenstoffatome ein Elektron heraus. „Danach passiert zunächst einmal nichts. Erst nach einigen Dutzend Femtosekunden lösen sich nach und nach Kohlenstoffatome von dem Molekül“, berichtet Teammitglied Robin Santra vom Forschungszentrum DESY in Hamburg. Typischerweise verlassen etwa 25 neutrale und 15 elektrisch geladene Kohlenstoffatome das Molekül. Aus den Überresten bilden sich schließlich Fragmente aus jeweils mehreren Atomen.
Der gesamte Prozess dauert rund 600 Femtosekunden, so Berrah und ihre Kollegen. Nach menschlichen Maßstäben ist das unvorstellbar kurz, für die Strukturanalyse mit Röntgenlasern jedoch extrem lang. Bei diesem Verfahren züchten Forscher in der Regel kleine Kristalle aus den Biomolekülen. Anschließend wird Röntgenlicht am Kristallgitter gestreut und erzeugt ein typisches Beugungsmuster, aus dem sich die Kristallstruktur und damit auch die räumliche Struktur der einzelnen Proteine berechnen lassen. Diese Daten erlauben dann Rückschlüsse auf deren genaue Funktionsweise.
Auch die Proteinkristalle lösen sich durch den Röntgenlaserblitz auf. Der Kristall bleibt allerdings lange genug intakt, um ein Beugungsbild zu erzeugen. Die neue Studie untermauert nun, dass dies auch bei einzelnen Molekülen der Fall ist, die sich nicht in einem Kristallgitter befinden. Das sind gute Nachrichten, denn viele Biomoleküle sind sehr schwer zu kristallisieren. Daher hoffen Forscher, mit dem Röntgenlaser künftig auch die Struktur von Ensembles einzelner Proteine oder sogar von einzelnen Biomolekülen bestimmen zu können.
DESY/Zoltan Jurek
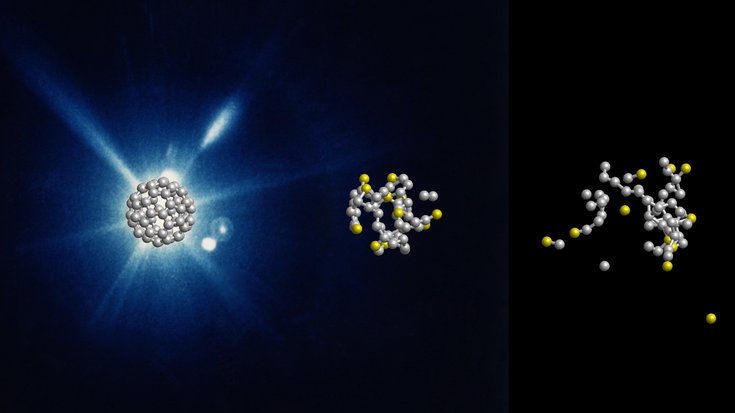
Echtzeitsimulation der Dynamik eines Kohlenstoff-60-Moleküls, das von einem Röntgenlaserpuls ionisiert wird. Die Farbe zeigt die wechselnden Ladungszustände der Kohlenstoffatome an.
Quelle: Pressemitteilung des Forschungszentrums DESY
Quelle: https://www.weltderphysik.de/gebiet/teilchen/nachrichten/2019/zerberstendes-biomolekuel-im-roentgenlaser/