„Ganz ähnlich wie Spannbeton“
Denise Müller-Dum

Max-Planck-Institut für Kolloid- und Grenzflächenforschung/David Ausserhofer
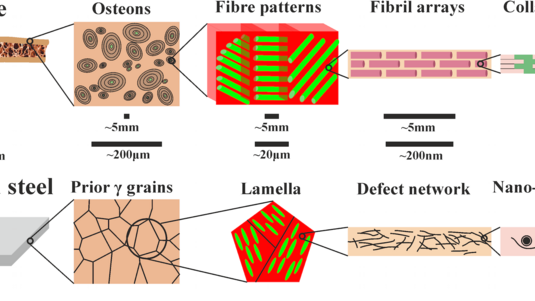
Knochen bestehen aus weichem, elastischem Kollagen und festem Mineral. Die Kombination dieser beiden Materialien macht Knochen besonders belastbar und bruchfest. Welche Prozesse auf der Nanoebene für diese besonderen Eigenschaften verantwortlich sind und wie sie sich mit Röntgenstrahlen untersuchen lassen, berichtet Wolfgang Wagermaier vom Max-Planck-Institut für Kolloid- und Grenzflächenforschung in Potsdam im Interview mit Welt der Physik.
Welt der Physik: Woraus bestehen Knochen?
Wolfgang Wagermaier: Knochen bestehen unter anderem aus Kollagen. Dieses Protein bildet eine faserige Struktur, die man an vielen Stellen im menschlichen Körper findet – etwa in der Haut oder in den Muskeln, und auch in Sehnen. Doch im Vergleich zu Sehnen kommt in Knochen noch ein weiteres Material hinzu: Das Mineral Kalziumphosphat, auch Hydroxylapatit genannt, ist in die Kollagenstruktur eingelagert. Die festen Mineralpartikel sind sehr klein und wechselwirken mit dem weichen Kollagen, sodass ein sogenanntes Hybridmaterial entsteht. Dieses ist zwar fest, aber durch den Kollagenanteil nicht so spröde wie etwa Keramik, sondern zäher.
Also erhält man gewissermaßen Knochen, wenn man Sehnen Minerale hinzufügt?
Das ist natürlich etwas vereinfacht dargestellt, aber aus Sicht der Materialwissenschaften nicht falsch. Tatsächlich haben wir genau das in unseren Experimenten versucht: Wir haben die Kollagenstrukturen von Sehnen künstlich mineralisiert, um diesen Prozess und die sich verändernden Materialeigenschaften zu untersuchen.
Wie genau liefen diese Experimente ab?
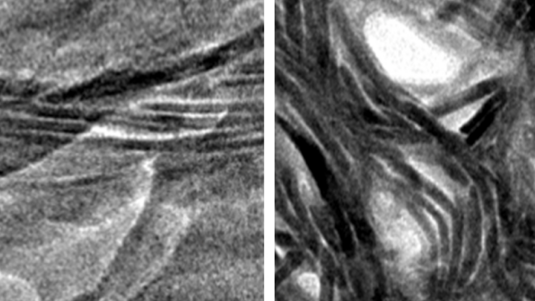
Wir haben wenige Zentimeter lange Probenstücke von Truthahnsehnen genommen und in verschiedene Lösungen aus Kalzium- und Strontium-Verbindungen gelegt. Die gelösten Minerale durchdrangen die Kollagenstruktur und kristallisierten dann innerhalb der Struktur aus. Das hat also funktioniert. Aber als wir die Probe unter dem Mikroskop anschauen wollten, tauchte ein Problem auf: Während der Mineralisation hat sich das Probenstück, das auf einem Glasträger klebte, immer unter dem Klebeband herausgezogen. Das war ein interessanter Effekt! Denn durch die Mineralisation schien eine unerwartete Kraft aufzutreten.
Wie haben Sie diesen Effekt dann weiter untersucht?
Die mechanische Belastung haben wir mit einer maßgeschneiderten Zugprüfanlage gemessen und so die makroskopische Kraft bestimmt, mit der sich das Sehnenstück zusammenzieht. Um allerdings zu verstehen, was auf der mikroskopischen Ebene und auch auf der Nanoebene passiert, haben wir unser Experiment mit der Röntgenlichtquelle BESSY II am Helmholtz-Zentrum Berlin untersucht.
Können Sie die Versuche an BESSY II genauer beschreiben?
Mit den brillanten Röntgenstrahlen von BESSY II kann man sich Strukturen mit sehr kurzen Belichtungszeiten anschauen. Das war für uns wichtig, denn wir hatten es ja mit einem sehr dynamischen Prozess zu tun. So haben wir Röntgenlicht in relativ kurzen Pulsen auf die Probe geschickt, die in unserem Fall aus einem Mineral mit hoher Elektronendichte und dem Kollagen mit einer geringeren Elektronendichte bestand. Und das ergibt bei unserer Methode, der Röntgenkleinwinkelstreuung, einen Kontrast, ein sogenanntes Streubild. Daraus lassen sich zum Beispiel die Größe der Mineralpartikel und der Kollagenmoleküle und die Abstände zwischen ihnen bestimmen. Wir haben also nicht nur gemessen, wie weit die Mineralisation fortgeschritten war, sondern auch, wie stark sich die Kollagenfasern zusammenzogen.
Was haben Sie dabei beobachtet?
Man kann sich das so vorstellen: Die Sehne besteht aus Bündeln von Kollagen. Die einzelnen Moleküle sind immer gleich lang, etwa 300 Nanometer, und außerdem sind die Moleküle in Schichten leicht gegeneinander versetzt. Das heißt, man hat sehr regelmäßige Abstände, fast wie in einem Kristall. In die Lücken zwischen dem Kollagen fließt die Minerallösung hinein. Die Mineralisation beginnt und kleinste Partikel lagern sich ab. Dadurch beginnt die Kontraktion der Kollagenfasern, die sich dann auf größere Ebenen überträgt – bis sich das Probenstück sogar unter dem Klebestreifen herausziehen kann.
Welche Folge hat diese Kontraktion der Kollagenfasern?
Das gesamte Hybridmaterial steht dadurch unter Spannung, was vor allem seine mechanischen Eigenschaften verbessert. Man kann das mit Spannbeton vergleichen, den man zum Beispiel im Brückenbau verwendet, um die Festigkeit von Bauelementen zu erhöhen. Dazu nimmt man Beton, bettet darin Stahldrähte ein und zieht dann alles zusammen. Dabei entsteht eine mechanische Spannung im Material – die sogenannte Vorspannung –, wodurch die Bruchfestigkeit des Materials erhöht wird. Und das ist im Knochen ganz ähnlich: Die Kollagenfasern drücken sozusagen die Mineralpartikel zusammen.
Welche Bedeutung haben Ihre Erkenntnisse?
Zum einen lässt sich unser Experiment auch mit anderen Mineralen als Hydroxylapatit durchführen und könnte damit zu weiteren Erkenntnissen über Mineralisationsprozesse und die dabei entstehenden Kräfte führen. Außerdem könnten unsere Ergebnisse dabei helfen, knochenähnliche Materialien beispielsweise für Implantate herzustellen. Und auch für andere Bereiche der Medizin ist unsere Studie relevant. Denn es gibt Knochenkrankheiten, bei denen der Grad der Mineralisation des Knochens eine wichtige Rolle spielt – etwa die Osteoporose oder die Glasknochenkrankheit. Auch dafür ist es wichtig, die Mineralisationsprozesse genau zu verstehen.
Quelle: https://www.weltderphysik.de/gebiet/leben/zwischen-belebtem-und-unbelebtem/materialforschung-ganz-aehnlich-wie-spannbeton/