„Wer rastet, der rostet“
Gabriele Schönherr
Rasi Bhadramani/iStock
Biologische Gelenke – wie etwa Knie, Hüfte oder Schulter – sind ein erstaunliches Wunderwerk der Natur: Gesunder Knorpel gleitet nahezu perfekt und mit extrem wenig Reibung übereinander. Die Reibung in einem biologischen Gelenk ist sogar hundertmal geringer als in einem mechanischen Gelenk. Deshalb haben Forschende den physikalischen Mechanismus biologischer Gelenke nun auf der Ebene einzelner Moleküle im Detail untersucht. Im Interview spricht Markus Valtiner von der Technischen Universität Wien über die Ergebnisse der Experimente und berichtet, was sich daraus für mechanische Gelenke und neue Therapiestrategien lernen lässt.
Welt der Physik: Warum sind biologische Gelenke so besonders?
Markus Valtiner: Das Besondere am biologischen Gelenk ist, dass die Natur im Laufe der Evolution einen Weg gefunden hat, unglaublich niedrige Reibungskoeffizienten zu erreichen. Das heißt: Selbst wenn die Gelenkoberflächen mit erheblicher Kraft aufeinanderdrücken, bleibt die Reibungskraft, die auf die Oberflächen wirkt, in einem gesunden Gelenk extrem gering. Als Grenzflächenphysiker möchte ich die Mechanismen verstehen, die das möglich machen: Wie schafft es die Natur, die Reibung – und damit den Verschleiß – so gering zu halten?
Kann die Natur es besser als die Technik?
In gesunden biologischen Gelenken ist die Reibung um bis zu zwei Größenordnungen geringer als in herkömmlichen technischen Gelenken. In Maschinen versucht man meist, mit Ölen oder ähnlichen Stoffen die Reibung an Oberflächen zu minimieren – doch man schafft nicht, was die Natur schafft. Reibung und Verschleiß in Maschinen erzeugen weltweit jährliche Kosten von mehreren Prozent des globalen Bruttoinlandprodukts und verbrauchen rund ein Fünftel des weltweiten Energiebedarfs.
Und welche Rolle spielt Verschleiß für biologische Gelenke?
Für alternde sowie stark belastete biologische Gelenke ist Verschleiß ein enormes Problem. In Umfragen geben etwa ein Viertel der befragten Menschen an, Gelenkprobleme zu haben. Die sind oftmals durch Arthrose, also Gelenkverschleiß, verursacht. Daher wollen wir den natürlichen Schutzmechanismus im gesunden Gelenk besser verstehen und herausfinden, ob und wie wir ihn auf technische und biomedizinische Anwendungen übertragen können.
Wie sind Sie dieser Frage nachgegangen?
Wir haben auf atomarer Ebene untersucht, was passiert, wenn im Gelenk Oberflächen mit unterschiedlichen Aggregatzuständen aufeinandertreffen. Wir nennen diese Oberflächen auch Grenzflächen, denn sie haben besondere Eigenschaften: Trifft zum Beispiel ein Festkörper auf eine Flüssigkeit, so ist die Flüssigkeit an der Grenzfläche anders strukturiert als im Inneren und auch die Oberfläche des Festkörpers kann eine andere Struktur annehmen als der Rest des Materials. Um die Grenzflächen in biologischen Gelenken zu untersuchen, haben wir uns auf die hochauflösende Analyse von Flüssigkeitsfilmen zwischen den Gelenken fokussiert.
Welche Rolle spielen Flüssigkeitsfilme in Gelenken?
Seit langem wird vermutet, dass spezielle Flüssigkeitsfilme die Gelenkschmierung maximieren und damit die Reibung im Gelenk minimieren – man spricht von einer sogenannten Superschmierung. Die Hypothese ist, dass Lubrizin – das ist ein Bestandteil der Gelenkflüssigkeit – für die Superschmierung verantwortlich ist. Lubrizin ist ein wirklich spannendes Molekül. Es ist unter anderem sehr hydrophil und bindet dadurch Wassermoleküle in seinem Inneren. Wird Lubrizin unter Druck gesetzt, kann das gebundene Wasser wieder entweichen und schmiert somit die Gelenkflächen. Die Gelenkflächen reiben dann quasi auf dem Wasser – ähnlich wie man beim Schlittschuhlaufen durch den Druck auf das Eis quasi auf dem Wasserfilm auf der Eisfläche gleitet. Entscheidend im Gelenk ist, dass das Wasser einen glatten und stabilen Flüssigkeitsfilm bildet. Den genauen Mechanismus dafür haben wir kürzlich nachgewiesen.
Was genau haben Sie herausgefunden?
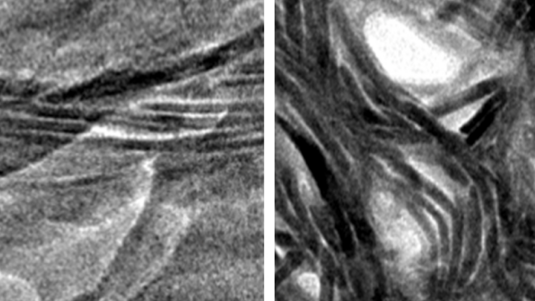
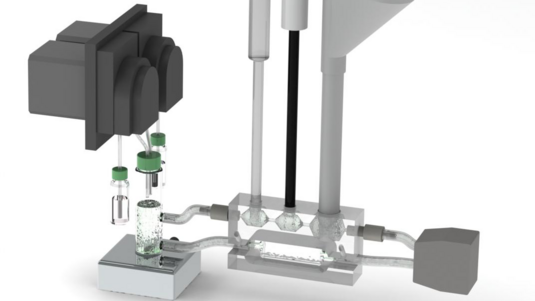
Wir konnten bei atomarer Auflösung nachvollziehen, wie sich der superschmierfähige Flüssigkeitsfilm aufbaut. Und wir haben nachgewiesen, dass die Konzentration und die Bindungsfähigkeit der Lubrizinmoleküle entscheidend dafür sind. In unseren Experimenten haben wir anstelle des Lubrizins in Wasser gelöste Lanthanionen, das sind elektrisch geladene Moleküle mit ähnlichen Bindungseigenschaften wie Lubrizin, untersucht. Denn im Vergleich zum Lubrizin sind Lanthanionen leichter verfügbar und auch für spätere medizinische Anwendungen interessant. Die Reibung der Gelenkoberflächen haben wir über einen bewährten Modellaufbau simuliert: Wir haben zwei zylindrische, stark negativ geladene Oberflächen, mit Druck gegeneinander bewegt. Und zwischen diesen Oberflächen war der Wasserfilm mit den gelösten Lanthanionen.
Was ist dann passiert?
Wir haben beobachtet, wie sich die positiven Lanthanionen an die negativ geladenen Oberflächen der Zylinder anlagern, dort sozusagen „festhalten“ und lokal Wassermoleküle an sich binden. Je nach Konzentration der Ionen verändert sich dann der Wasserfilm: Bei niedriger Konzentration hat er viele Löcher – praktisch wie eine raue Oberfläche. Die Reibung ist also ziemlich hoch. Bei höherer Ionenkonzentration bildet sich eine zunehmend glatte Wasseroberfläche, bis die Reibung perfekt minimiert ist. Bei noch höherer Ionendichte entstehen wieder neue „Berge“ und „Täler“, die zu einer höheren Reibung führen. Damit haben wir nach einem Jahrzehnt Forschung die entscheidende Rolle der Ionen für die Reibung in Gelenken auch wirklich sicher nachgewiesen. Wir haben nun erstmals atomar aufgelöste Bilder und dazu gemessene Reibungskoeffizienten, dir wir auch mit theoretischen Simulationen vergleichen können.
Lassen sich diese Erkenntnisse auf technische Systeme übertragen?
Ich denke schon, denn wir kennen jetzt die relevanten Einflussgrößen. Das ist wirklich ein sehr schlauer Schachzug der Natur: Immer dann, wenn sich die Reibung durch Druck erhöht, wird der Gleitfilm in biologischen Gelenken noch besser – und das ebenfalls durch den Druck. Das können technische Systeme in der Regel noch nicht leisten. Meist bestehen technische Gelenke nur aus Öl und zwei Hartstoffen, aber aus keinem Bestandteil, der etwa weiteres Öl hinzufügt. Ich glaube, unsere Ergebnisse werden uns ermöglichen, neue Materialien mit ähnlichen Eigenschaften wie Lubrizin zu entwickeln – die aber vielleicht gar nicht wie Lubrizin aussehen oder sogar ganz anders funktionieren. Zurzeit wird beispielsweise viel an porösen Systemen mit schwammartigen Strukturen geforscht. Da gibt es wahnsinnig spannende Effekte auf molekularer Ebene.
Wird es in Zukunft auch neue Behandlungsstrategien gegen biologischen Gelenkverschleiß geben?
Viele der heutigen Therapien versuchen nur, die Schmerzen zu lindern und die Reibungsfähigkeit temporär wiederherzustellen, zum Beispiel indem man Hyaluronsäure injiziert. Das ist etwa vergleichbar mit Öl in Maschinen, denn man fügt zwar ein Schmiermittel hinzu, kann aber nicht beeinflussen, wo es bleibt. Deshalb gibt es heute schon erste Therapieideen mit dreifach geladenen, stark wasseranziehenden Ionen: Das positiv geladene Lubrizin hält sich ja in unseren Gelenken auf einer negativen Oberfläche fest. Wenn es zu versagen beginnt, könnte man positive Ionen wie Lanthan injizieren. Damit würde man quasi die Lücken im Lubrizin füllen, den Halt des Flüssigkeitsfilms wieder verstärken und so die ursprüngliche, natürliche Grenzflächenstruktur so gut es geht erhalten.
Und was können wir selbst für unsere Gelenke tun?
Unsere Gelenke bewegen. So vermeiden wir, dass die Lubrizinmoleküle degradieren. Das kann zum Beispiel passieren, wenn sich Ablagerungen an den Lubrizinmolekülen ansammeln und die Moleküle dadurch ihre Fähigkeit verlieren, Wasser aufzunehmen, um den Gleitfilm zu erzeugen. Wer rastet, der rostet – das gilt für unsere Gelenke sozusagen im wahrsten Sinne des Wortes.
Quelle: https://www.weltderphysik.de/gebiet/leben/zwischen-belebtem-und-unbelebtem/gesundheit-wer-rastet-der-rostet/