Wie funktioniert die C-14-Methode?
Kim Hermann und Lisa Leander

Alfred-Wegener-Institut
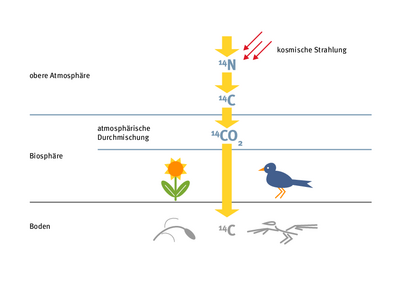
Mit der 14C-Methode – auch Radiokohlenstoffdatierung oder Radiokarbonmethode genannt – bestimmen nicht nur Archäologen das Alter von Funden. Auch den globalen Kohlenstoffkreislauf untersuchen Forscher mit dieser Methode. Sie beruht auf dem Zerfall eines bestimmten Kohlenstoffisotops, das in den oberen Schichten der Atmosphäre entsteht und später von allen Lebewesen und den Ozeanen auf der Erde aufgenommen wird.
Während des zweiten Weltkriegs entwickelte der Chemiker Willard Frank Libby die Radiokohlenstoffdatierung, als er die Effekte der sogenannten kosmischen Strahlung erforschte. Permanent treffen diese extrem energiereichen Teilchen aus dem Weltall auf die Erdatmosphäre. Die kosmische Strahlung enthält unter anderem auch hochenergetische Neutronen – die gemeinsam mit Protonen die Bausteine von Atomkernen bilden. In der oberen Atmosphäre treffen die Neutronen wiederum auf Stickstoffatome. Der Kern dieser Stickstoffatome besteht aus sieben Neutronen sowie sieben Protonen – und wird auch als 14N bezeichnet, wobei N das Elementsymbol für Stickstoff ist und 14 für die Gesamtzahl der Kernbausteine steht.
„Die Neutronen aus der kosmischen Strahlung reagieren mit dem Stickstoff“, erklärt Gesine Mollenhauer vom Alfred-Wegener-Institut in Bremerhaven. Dabei verliert 14N ein Proton und es entsteht das Kohlenstoffisotop 14C mit sechs Protonen sowie acht Neutronen. „14C reagiert mit Sauerstoff zu CO2 und geht so in den Kohlenstoffkreislauf ein“, so Mollenhauer. Doch 14C ist radioaktiv – eines der Neutronen im Kern wandelt sich in ein Proton um, gibt dabei ein Elektron und ein Elektron-Antineutrino ab und sendet Betastrahlung aus. Das Kohlenstoffisotop zerfällt wieder zu Stickstoff und das mit einer Halbwertszeit von 5730 Jahren.
Der Gehalt von 14C in der Erdatmosphäre ist sehr gering. Das Verhältnis zu den zwei anderen natürlich vorkommenden, stabilen Kohlenstoffisotopen beträgt ungefähr eins zu einer Billion. Dennoch ist 14C wie die beiden anderen Isotope 12C und 13C auf der Erde nachweisbar: Pflanzen nutzen es in Form von Kohlenstoffdioxid für die Photosynthese, Tiere und Menschen nehmen es über die Nahrungskette auf. Gleichzeitig entweicht Kohlenstoff wieder in die Atmosphäre, etwa wenn Lebewesen atmen, Mikroorganismen Abfallprodukte zersetzen oder Gas aus den Meeren freigesetzt wird.
Basierend auf dem radioaktiven Zerfall von 14C sowie seiner Aufnahme in alle Lebewesen, erkannte Libby, dass sich über diesen Kreislauf das Alter von konservierten Pflanzenresten oder Knochen bestimmen lässt: Denn stirbt ein Organismus, nimmt er kein neues 14C mehr auf, stattdessen sinkt die Zahl der Atome durch den radioaktiven Zerfall. Über die Halbwertszeit kann man dann zurückrechnen, wann der Stoffwechsel aussetzte. Das ist bis zu einem Alter von 50 000 bis 60 000 Jahren möglich, bei noch älteren Funden sind schon so viele Atome zerfallen, dass der 14C-Gehalt nicht mehr zuverlässig nachweisbar ist.
Einflüsse auf den 14C-Gehalt in der Atmosphäre
Libby erhielt für seine Methode 1960 den Chemienobelpreis. Einen Haken hat die Datierung über 14C jedoch: Der Gehalt des Isotops in der Atmosphäre ist nicht immer gleich. Er hängt von zwei Faktoren ab: von der Stärke der kosmischen Strahlung und von Änderungen im Kohlenstoffkreislauf. Ein Teil der kosmischen Strahlung besteht aus Teilchen, die von der Sonne auf die Erde gelangen. Da die Sonnenaktivität zyklisch zu- und abnimmt, variiert damit auch die Intensität der Strahlung. „Aber auch andere kosmische Phänomene wie etwa eine Supernova können zu Veränderungen in der kosmischen Strahlung führen“, erklärt Mollenhauer. „Zudem schirmt das Erdmagnetfeld die Erde vor der einfallenden Strahlung ab.“ In Zeiten mit stärkerem Erdmagnetfeld wird auch die kosmische Strahlung stärker abgeschirmt und es entsteht weniger 14C in der oberen Atmosphäre.
Dagegen wird der Kohlenstoffkreislauf vor allem durch das Erdklima beeinflusst. Die letzte Eiszeit etwa veränderte die gesamte Flora und Fauna in Europa: Große Landflächen waren unter Gletschern begraben, Steppengebiete breiteten sich aus, Wälder gingen zurück. Heftige Vulkanausbrüche haben ebenfalls einen Einfluss auf das Verhältnis der Kohlenstoffisotope. „Einen bedeutenden Einfluss auf den 14C-Gehalt der Atmosphäre hat außerdem die Ozeanzirkulation“, berichtet Mollenhauer. „Denn das CO2 der Atmosphäre wird von den Ozeanen aufgenommen und durch die Zirkulation ins Tiefenwasser der Weltmeere transportiert. Verlangsamt sich die Zirkulation, bleibt mehr 14C in der Atmosphäre. So lässt sich mit der 14C-Methode auch der globale Kohlenstoffkreislauf untersuchen.“ Einen immer stärkeren Einfluss hat zudem der Mensch, der seit der Industrialisierung erhebliche Mengen an fossilen Kraftstoffen verbrennt. Ähnlich wie vulkanische Gase aus tiefen Schichten der Erde enthält das CO2 aus industriellen Prozessen so gut wie kein 14C, da Öl und Kohle über Millionen von Jahren entstehen. Ihre Verbrennung senkt den 14C-Gehalt in der Atmosphäre. In Zukunft könnte aufgrund dieses sogenannten Suess-Effekts der 14C-Gehalt sogar so stark sinken, dass in Proben irgendwann nicht mehr genug 14C für eine Datierung vorhanden ist.
Seit Mitte des 20. Jahrhunderts wird der Suess-Effekt jedoch überlagert: Durch zahlreiche Atomwaffentests – wie sie vor allem die USA und die Sowjetunion in den 1950er-Jahren durchführten – entstanden ungewöhnlich viele freie Neutronen in den oberen Luftschichten. Dadurch verdoppelte sich vorübergehend der 14C-Gehalt beinahe. Mittlerweile ist der Gehalt in der Atmosphäre wieder deutlich zurückgegangen, nachdem sich das zusätzliche 14C über den Kohlenstoffkreislauf verteilen konnte, wo es nun langsam zerfällt. Proben aus den Jahren nach 1950 weisen daher einen charakteristisch höheren Wert an 14C auf. Die Atombombentests könnten damit zukünftigen Archäologen die Datierung schwer machen, sollten sie in 1000 oder 2000 Jahren in Vergessenheit geraten.
Kalibrierung der Messwerte
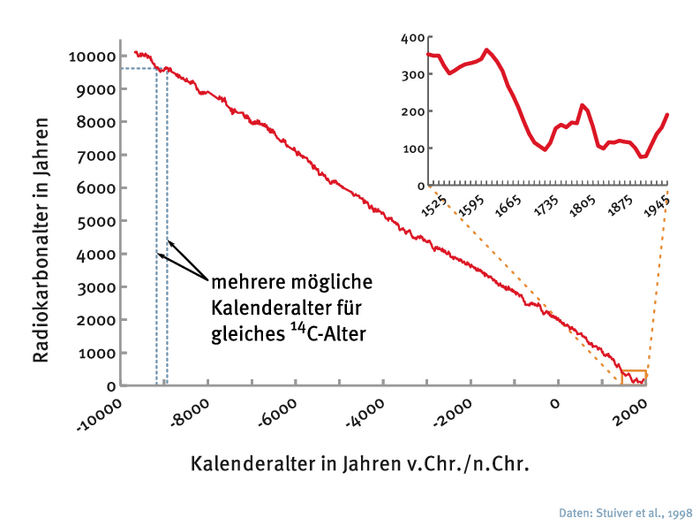
Da so viele Faktoren den 14C-Gehalt beeinflussen, müssen die Messungen mit weiteren Methoden kalibriert werden, um das genaue Alter von Proben zu ermitteln. Dazu eignet sich zum Beispiel die sogenannte Dendrochronologie, bei der Jahresringe von Bäumen datiert werden. Jahresringe von Bäumen sind unterschiedlich dick, da das Wachstum vom Klima und anderen Bedingungen abhängt. Die charakteristische Abfolge von dicken und dünnen Ringen kann genutzt werden, um Baumringsequenzen von fossilen Bäumen genauestens zu datieren. Vergleichen Wissenschaftler datierte Ringe aus verschiedenen Zeiten mit dem 14C-Gehalt im Holz, ergeben sich daraus Kalibrierungskurven, die sich auch auf andere 14C-Proben anwenden lassen. Mithilfe besonders alter Bäume oder im Moor versunkener Stämme können sie so bis 12 000 Jahre zurückrechnen. Um ältere Funde abzugleichen, ist die Uran-Thorium-Methode hilfreich. „Der Zerfall der radioaktiven Elemente in versteinerten Korallen und in Tropfsteinen erweitert die Zeittafel“, so Mollenhauer. „Einen entscheidenden Beitrag zu den Kalibrierungskurven leistet der Suigetsu-See in Japan. Sein Sediment weist Jahreslagen auf, die über 50 000 Jahre zurückreichen und sich ähnlich wie die Jahresringe eines Baums abzählen lassen.“
Eine wichtige Voraussetzung für Messungen mit der 14C-Methode ist, dass an der Probe keine fremden Partikel haften, die das Alter verfälschen. Dabei kommt es nicht nur auf sauberes Arbeiten der Forscher an, denn bereits im Erdboden kann etwa aufsteigendes Grundwasser Ablagerungen auf Holz oder Knochen hinterlassen. Deshalb werden die Proben in jedem 14C-Labor vorher chemisch gereinigt. Am Ende bleibt eine Messungenauigkeit von einigen Jahrzehnten, die auf statistischen Schwankungen und Ungenauigkeiten der Instrumente beruht. Steht genug Probenmaterial zur Verfügung, kann länger gemessen werden, wodurch zumindest der statistische Fehler kleiner ausfällt.
Doch selbst bei genauen Messungen haben Wissenschaftler manchmal Probleme, das tatsächliche Alter zu ermitteln. Denn die Kalibrierungskurven der Dendrochronologie und der Uran-Thorium-Methode bilden an einigen Stellen Plateaus, die längere Zeitabschnitte darstellen, in denen der 14C-Gehalt von Funden kaum variiert. Eine solche Phase gab es zuletzt zwischen 1650 und 1950, trotz des einsetzenden Suess-Effekts. Deshalb lässt sich die 14C-Methode bei Proben aus dieser Zeitspanne nicht zuverlässig anwenden.
Methoden und Geräte
Mit der 14C-Methode lässt sich neben organischem Material auch anorganisches Material untersuchen, das 14C in Form von Kohlenstoffverbindungen enthält. Um den Isotopengehalt von 14C einer Probe zu bestimmen, nutzte man ursprünglich Zählrohre wie den Geigerzähler. Sie registrieren den Zerfall der verbleibenden 14C-Kerne anhand der ausgesandten Betateilchen, die mit einem Edelgas im Rohr reagieren. Allerdings benötigt man für dieses Verfahren eine Probe von einigen Hundert Gramm.
„Je nach 14C-Gehalt werden unterschiedliche Methoden zur Bestimmung genutzt“, berichtet Mollenhauer. „Es gibt Methoden, die nur angewendet werden, wenn der 14C-Gehalt in der Probe höher als der Gehalt in der Atmosphäre ist.“ Das ist bei der sogenannten Isotopenmarkierung der Fall: Dabei geht es nicht um die Altersbestimmung einer Probe. Vielmehr wird in Experimenten der 14C-Gehalt der Probe künstlich erhöht, um chemische und biologische Prozesse wie etwa die Aufnahme von CO2 in Algen nachzuverfolgen: Die Alge nimmt CO2 auf, dessen Kohlenstoffatom durch das Isotop 14C ersetzt wurde. Um zu untersuchen, wieviel CO2 die Alge nach einer gewissen Zeit gebunden hat, kann man nun den 14C -Gehalt der Alge bestimmen.
Für Proben mit einem natürlichen 14C-Gehalt ist die Beschleunigermassenspektrometrie – oder kurz AMS für den englischen Begriff „Accelerator Mass Spectrometry“ – die gängigste Methode. Die AMS zählt nicht die 14C-Zerfallsereignisse, sondern die Atome selbst. Dazu wird der gesamte Kohlenstoff aus einer Probe zu Graphit umgewandelt und mit Cäsiumionen beschossen, um geladene Kohlenstoffionen zu erzeugen. Da die einzelnen Isotope und damit auch ihre Ionen unterschiedliche Massen haben, können die Ionen des 14C-Isotops in einem Massenspektrometer von den anderen Kohlenstoffionen abgetrennt werden. Allerdings können die Proben auch andere Ionen mit der gleichen Masse wie 14C enthalten – etwa Moleküle aus 13C und einem Wasserstoffion. Damit diese Moleküle im Massenspektrometer nicht fälschlicherweise als 14C-Isotop gezählt werden, zerlegt der Beschleuniger die Moleküle in ihre Bestandteile. „Die Technik ist mittlerweile so weit fortgeschritten, dass nicht nur festes Graphit ionisiert werden kann, sondern auch gasförmiges CO2“, berichtet Mollenhauer. „So können Beschleunigerspektrometer sogar kleinste Proben von nur einem Zehntel Milligramm analysieren.“
Anmerkung der Redaktion: Die erste Version dieses Artikels, die 2010 auf Welt der Physik erschien, verfasste Lisa Leander. Im März 2021 hat Kim Hermann den Text überarbeitet und aktualisiert.
Quelle: https://www.weltderphysik.de/thema/hinter-den-dingen/c-14-methode/