Radioaktivität
Jens Kube

dennisvdw/iStock
In der Natur kommen insgesamt achtzig stabile chemische Elemente vor. Die Atomkerne der übrigen Elemente im Periodensystem zerfallen über kurz oder lang radioaktiv – und senden dabei sogenannte ionisierende Strahlung aus. Woraus diese Strahlung besteht, wie man sie misst und was sie in hohen Dosen gefährlich macht, erklärt Helmut Fischer von der Landesmessstelle für Radioaktivität an der Universität Bremen in dieser Folge des Podcasts.
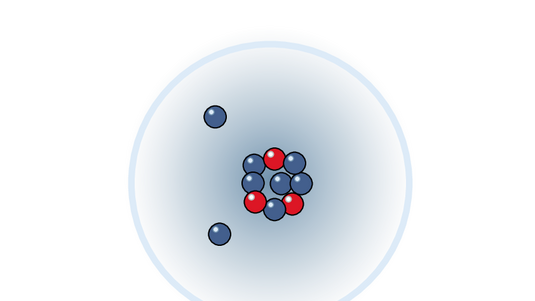
Alle Materie im Universum ist aus Atomen aufgebaut, die sich jeweils aus einem Atomkern und einer Hülle aus Elektronen zusammensetzen. Um welches chemische Element es sich handelt, wird durch die Anzahl von Protonen im Atomkern festgelegt. So besitzt ein Wasserstoffatom immer genau ein Proton im Kern, ein Heliumatom zwei und ein Uranatom ganze 92. Dazu kommen noch Neutronen, oft einige mehr als Protonen.
Helmut Fischer: „Und diese Protonen und Neutronen halten durch verschiedene Kernkräfte zusammen, stoßen sich aber auch – weil die Protonen positiv geladen sind – gegenseitig ab. Also da sind ganz starke Kräfte am Werk, und die sind in einem Gleichgewicht.“
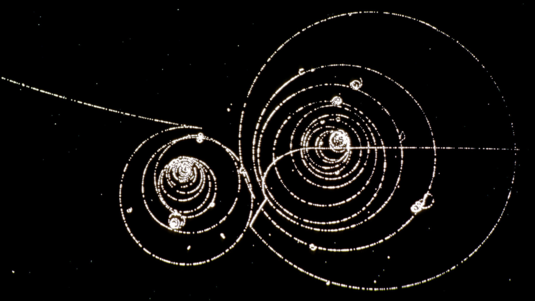
Im Gegensatz zur Anzahl von Protonen kann die Anzahl von Neutronen im Kern für ein und dasselbe chemische Element durchaus variieren. Dabei sind längst nicht alle diese Isotope – also verschiedene Kombinationen von Protonen und Neutronen – stabil. Mehr dazu in der 299. Folge unseres Podcasts.
Folge 299 – Radioaktivität
Quelle: https://www.weltderphysik.de/mediathek/podcast/radioaktivitaet/