Röntgenpulse machen 3D-Strukturen von Biomolekülen sichtbar
Jan Oliver Löfken

Bei der Suche nach neuen Medikamenten liefern dreidimensionale Strukturbilder von teils sehr großen und komplexen Biomolekülen wichtige Impulse. Diese Aufnahmen werden über die Streuung von Röntgenpulsen an kleinen Kristallen aus geordneten Biomolekülen gewonnen. Doch sehr viele Moleküle konnten mit dieser Methode bisher nicht analysiert werden. Mit einem verbesserten Verfahren, das Wissenschaftler aus den USA und Deutschland nun erprobt haben, könnte sich das ändern. In der Fachzeitschrift „Nature“ berichten sie, dass sie mit den Röntgenpulsen eines Freie-Elektronen-Lasers sowohl eine höhere Bildauflösung erzielten als auch Strukturdaten aus bisher zu verrauschten und unbrauchbaren Streubildern gewinnen konnten.
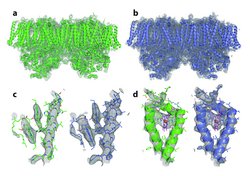
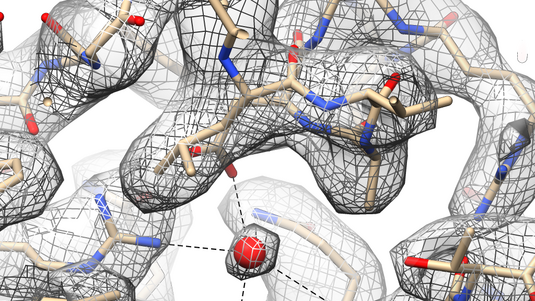
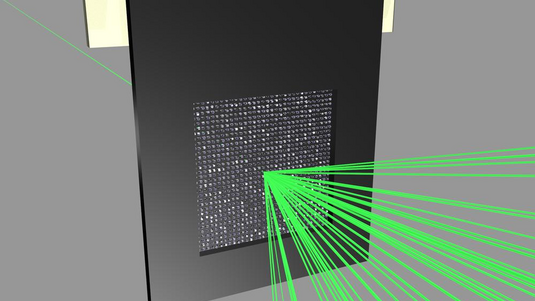
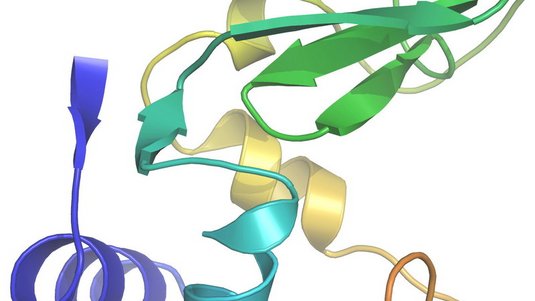
„Erstmals haben wir Zugang zu Streubildern einzelner Moleküle – das gab es zuvor in der Kristallographie noch nie“, sagt Henry Chapman vom DESY in Hamburg. So könne man nun atomare Details von großen Proteinkomplexen genau abbilden. Dieser Erfolg gelang Chapman zusammen mit seinen Kollegen mit dem weltweit stärksten Röntgenlaser am Stanford Linear Accelerator Center in Kalifornien. Hier schickten die Wissenschaftler intensive und kurze Röntgenpulse auf einen kristallisierten Proteinkomplex, der in Membranen von Pflanzenzellen an der Photosynthese beteiligt ist. Aus den Streubildern der Röntgenstrahlung konnte die dreidimensionale Struktur dieses Photosystem II genannten Membranproteins mit einer Auflösung von einem Drittel Nanometer exakter bestimmt werden als bisher.
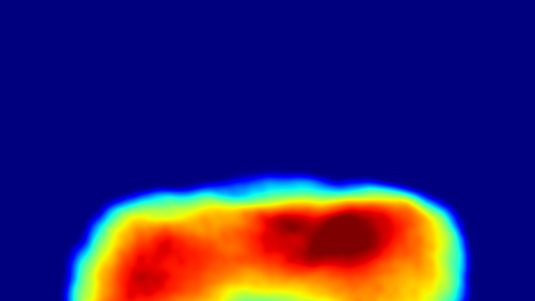
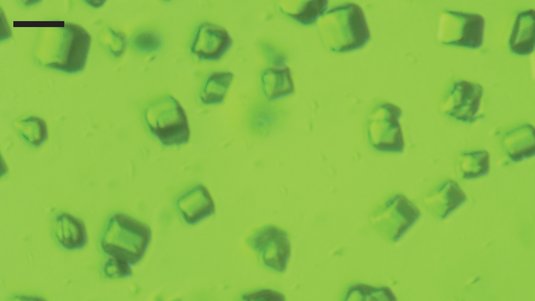
Dieser Testlauf zeigte, dass die Methode der sogenannten kohärenten Röntgenbeugung genauere 3D-Strukturen von Biomolekülen liefern konnte. Dabei musste das Biomolekül im Unterschied zu bisherigen Verfahren nicht einmal in möglichst perfekt kristallisierter Form vorliegen. Selbst ein auf den ersten Blick undeutliches, verrauschtes Streubild enthielt genug Informationen, um nach einer ausgeklügelten Auswertung ein dreidimensionales Strukturbild zu erhalten. Dabei spielte die erfolgreiche Bestimmung der Phasen der gestreuten Röntgenwellen eine zentrale Rolle.
Mit diesem Pilotversuch eröffnen sich nun viele neue Möglichkeiten für die Strukturanalysen über gestreute Röntgenpulse. Denn selbst Proteinkristalle von minderer Qualität, die bislang unbrauchbar waren, reichen nun für eine detaillierte Strukturbestimmung aus. „Diese Entdeckung besitzt das Potenzial, eine echte Revolution in der Kristallographie komplexer Materie zu werden“, sagt Helmut Dosch, Vorsitzender des DESY-Direktoriums. In weiteren Schritten wollen Chapman und Kollegen die räumliche Auflösung ihrer Aufnahmen weiter verbessern. Zudem könnten tausende Streubilder, deren Qualität für eine Strukturanalyse bisher zu schlecht waren, abermals darauf untersucht werden, ob auch sie bisher unerkannte Strukturdaten enthalten.
Wissenschaft aktuell gemäß den Bedingungen der Quelle
Quelle: https://www.weltderphysik.de/gebiet/teilchen/nachrichten/2016/roentgenpulse-machen-3d-strukturen-von-biomolekuelen-sichtbar/