Innere Struktur eines Biomoleküls mit Röntgenlaser aufgeklärt
Anna-Lotta Geyssel / DESY
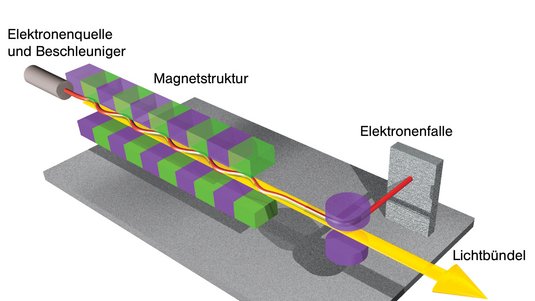
Menlo Park (USA) – Wenn Forscher bisher Röntgenstrukturanalysen an Synchrotronstrahlungsquellen durchführen wollten, waren vergleichsweise große und regelmäßige Kristalle der Probensubstanz nötig. Solche Kristalle lassen sich aber nicht aus allen Molekülen erzeugen. Wissenschaftler um Sébastien Boutet vom Beschleunigerzentrum SLAC in Kalifornien demonstrieren nun, dass die ultrakurzen und intensiven Röntgenblitze aus Freie-Elektronen-Lasern auch für schwer zu kristallisierende Moleküle eine hochauflösende Strukturanalyse ermöglichen.
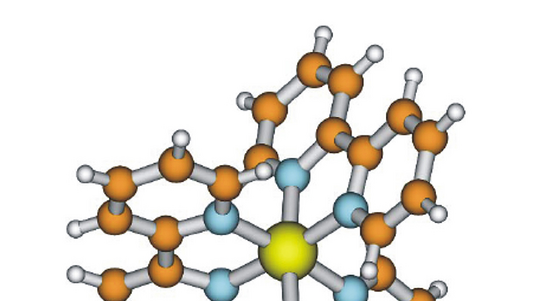
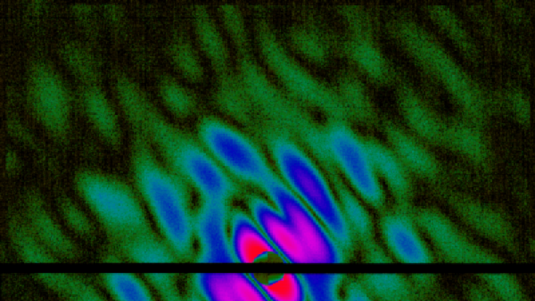
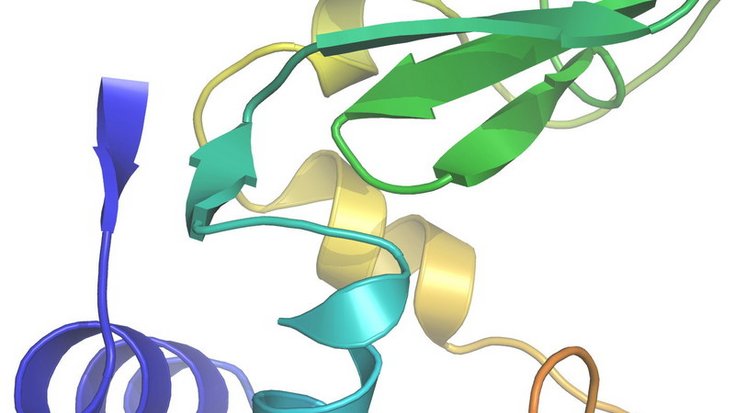
In ihrem Experiment nutzte das Forscherteam die extrem hellen Röntgenblitze der Linac Coherent Light Source am SLAC, um die Struktur des Enzyms Lysozym aus dem Hühnereiweiß zu untersuchen. Anstatt eines einzelnen, großen Kristalls untersuchten Boutet und seine Kollegen Millionen Mikrokristalle, die sie in einer Lösung senkrecht durch den Laser fließen ließen. Wenn die Röntgenstrahlen an dem Kristallgitter der Probe gebeugt werden, entstehen Beugungsbilder, die den Forschern dann Aufschluss über die Struktur des Kristalls geben. Dabei bestimmt die Wellenlänge der verwendeten Strahlung die Detailgröße, die sich noch erkennen lässt.
Anhand von 3,5 Millionen Röntgenblitzen registrierten sie damit rund 100.000 Beugungsreflexe, aus denen sie die Enzym-Struktur schließlich auf 0,19 Nanometer genau entschlüsselten. Weiterhin waren die Blitze nur fünf Billiardstel Sekunden kurz. So konnten Boutet und seine Kollegen die Informationen der untersuchten Biomoleküle aufnehmen, bevor Strahlungsschäden an der Probe auftraten. Ihre Ergebnisse verglichen sie mit früheren Analysen von sehr viel größeren Kristallen des gleichen Enzyms und fanden eine gute Übereinstimmung.
Somit belegten die Forscher, dass mithilfe von Freie-Elektronen-Lasern – wie der LCLS oder des in Hamburg am DESY im Bau befindliche European XFEL – auch Biomoleküle untersucht werden können, die nur schwer oder fast gar nicht zu kristallisieren sind. Die Struktur von Biomolekülen ist von großer Bedeutung für Medizin und Biologie, denn ihre Form bestimmt oft über ihre Funktion. Ausgehend von der Struktur eines Enzyms, das etwa für einen Zellrezeptor eine entscheidende Rolle spielt, lässt sich unter Umständen ein maßgeschneidertes Medikament entwickeln.
Welt der Physik / Pressemitteilung CC by-nc-nd
Quelle: https://www.weltderphysik.de/gebiet/teilchen/nachrichten/2012/innere-struktur-eines-biomolekuels-mit-roentgenlaser-aufgeklaert/