Entropie

Die Entropie wird oft missverständlich als eine Art „Unordnung“ bezeichnet. Doch das greift viel zu kurz. Einst eingeführt, um den begrenzten Wirkungsgrad von Dampfmaschinen zu erklären, wird der Begriff heute auch in vielen anderen Disziplinen genutzt.
Kaum ein Begriff der Physik wird so gerne außerhalb der Physik benutzt – und so oft abweichend von seiner eigentlichen Bedeutung – wie der der Entropie. Dabei hat der Begriff durchaus eine eng umrissene Bedeutung. Eine konkrete Definition dieser physikalischen Größe stellte der österreichische Physiker Ludwig Boltzmann in der zweiten Hälfte des 19. Jahrhunderts auf. Er konzentrierte sich auf das mikroskopische Verhalten eines Fluids, also eines Gases oder einer Flüssigkeit. Die ungeordnete Bewegung von Atomen oder Molekülen darin verstand er dabei als Wärme, was für seine Definition entscheidend war.
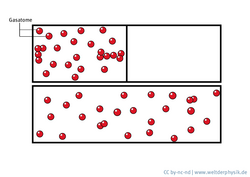
Entropie in der Badewanne
In einem abgeschlossenen System mit festem Volumen und fixer Teilchenzahl, so legte Boltzmann fest, ist die Entropie proportional zum Logarithmus der Anzahl von Mikrozuständen in dem System. Unter Mikrozuständen verstand er alle Möglichkeiten, wie sich die Moleküle oder Atome des eingesperrten Fluids anordnen können. Seine Formel definiert die Entropie somit als ein Maß für die „Anordnungsfreiheit“ der Moleküle und Atome: Steigt die Zahl der einnehmbaren Mikrozustände, dann wächst die Entropie. Gibt es weniger Möglichkeiten, wie sich die Teilchen des Fluids anordnen können, ist die Entropie kleiner.
Boltzmanns Formel wird oft so interpretiert, als sei die Entropie gleichbedeutend mit „Unordnung“. Dieses vereinfachte Bild führt allerdings leicht in die Irre. Ein Beispiel dafür ist der Schaum in einer Badewanne: Wenn die Bläschen zerplatzen und die Wasseroberfläche glatt wird, hat es den Anschein, als nehme die Unordnung ab. Die Entropie tut das aber nicht! Tatsächlich nimmt sie sogar zu, denn nach dem Zerplatzen des Schaums ist der mögliche Aufenthaltsraum für die Moleküle der Flüssigkeit nicht mehr auf die Außenhäute der Bläschen beschränkt – die Zahl der einnehmbaren Mikrozustände hat sich also vergrößert. Die Entropie ist gewachsen.
Mithilfe der Boltzmannschen Definition lässt sich eine Seite des Begriffs verstehen – doch die Entropie hat auch eine andere, makroskopische Seite, die der deutsche Physiker Rudolf Clausius bereits einige Jahre zuvor aufgedeckt hatte. Zu Beginn des 18. Jahrhunderts wurde die Dampfmaschine erfunden, eine klassische Wärmekraftmaschine. Wärmekraftmaschinen wandeln einen Temperaturunterschied in mechanische Arbeit um. Physiker versuchten damals zu begreifen, welchen Prinzipien diese Maschinen gehorchen. Die Forscher stellten nämlich irritiert fest, dass sich nur ein paar Prozent der thermischen Energie in mechanische Energie umwandeln ließen. Der Rest ging irgendwie verloren – ohne dass sie den Grund verstanden.
Wertigkeit der Energie
Der Theorie der Thermodynamik schien ein physikalisches Konzept zu fehlen, das die unterschiedliche Wertigkeit der Energie berücksichtigt und die Fähigkeit begrenzt, thermische Energie in mechanische Energie umzuwandeln. In Gestalt der Entropie kam die Lösung. Mitte des 19. Jahrhunderts führte Clausius den Begriff als thermodynamische Größe ein und definierte ihn als makroskopisches Maß für eine Eigenschaft, die die Nutzbarkeit von Energie begrenzt.
Clausius zufolge hängt die Entropieänderung eines Systems von der zugeführten Wärme und der dabei herrschenden Temperatur ab. Zusammen mit Wärme wird immer Entropie übertragen, so sein Fazit. Darüber hinaus stellte Clausius fest, dass die Entropie in geschlossenen Systemen, anders als die Energie, keine Erhaltungsgröße ist. Diese Erkenntnis ging als der zweite Hauptsatz der Thermodynamik in die Physik ein:
„In einem geschlossenen System nimmt die Entropie niemals ab.“
Die Entropie nimmt demnach immer zu oder bleibt konstant. Damit wird in die Physik geschlossener Systeme ein Zeitpfeil eingeführt, denn bei wachsender Entropie sind thermodynamische Prozesse in geschlossenen Systemen unumkehrbar (oder irreversibel).
Reversibel (umkehrbar) wäre ein Prozess nur dann, wenn die Entropie konstant bliebe. Das ist aber bloß theoretisch möglich. Alle realen Prozesse sind irreversibel. Frei nach Boltzmann kann man auch sagen: Die Zahl der möglichen Mikrozustände nimmt jederzeit zu. Diese mikroskopische Interpretation erweitert die thermodynamisch-makroskopische Interpretation durch Clausius. Durch die Entropie ließ sich das Rätsel um die verschwundene Energie in Wärmekraftmaschinen endlich auflösen (siehe Kasten). Ständig entzieht sich ein Teil der Wärmeenergie der mechanischen Nutzbarkeit und wird wieder abgegeben, weil die Entropie in geschlossenen Systemen nicht abnehmen darf.
Vielseitiger Einsatz
Seit den Erkenntnissen von Clausius und Boltzmann ist die Entropie auch in andere Bereiche der Physik eingezogen. Sogar außerhalb der Physik griff man sie auf, jedenfalls als mathematisches Konzept. Beispielsweise führte der US-amerikanische Mathematiker und Elektrotechniker Claude Shannon im Jahr 1948 die sogenannte Informationsentropie ein. Mit dieser Größe charakterisierte er den Informationsverlust in Übertragungen per Telefonleitung.
Auch in der Chemie und Biologie spielt die Entropie eine Rolle: In bestimmten offenen Systemen können sich neue Strukturen bilden, sofern Entropie nach außen abgegeben wird. Es muss sich dabei um sogenannte dissipative Systeme handeln, bei denen also Energie in thermische Energie umgewandelt wird. Diese Theorie der Strukturbildung stammt vom belgischen Physikochemiker Ilya Prigogine. Bis heute werden Arbeiten veröffentlicht, in denen der physikalischen Tragweite des Konzepts neue Aspekte hinzugefügt werden.
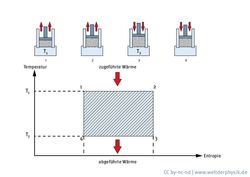
Warum ist der Wirkungsgrad von Wärmekraftmaschinen begrenzt? Rudolf Clausius löste dieses Rätsel, indem er den Begriff der Entropie einführte. Der Physiker betrachtete den Kreisprozess einer idealisierten Wärmekraftmaschine, bei dem sich Expansion und Kompression unter isothermen (konstante Temperatur) und isentropen (konstante Entropie) Bedingungen abwechseln. Durch Verknüpfung der Energieerhaltung mit dem zweiten Hauptsatz der Thermodynamik ergibt sich in diesem sogenannten Carnotprozess die folgende Ungleichung für den Wirkungsgrad:
\(\eta \le \frac{T_{1}-T_{2}}{T_{1}}\)
T1 und T2 sind die beiden Temperaturen, zwischen denen der Kreisprozess betrieben wird. Der maximal erreichbare Wirkungsgrad einer Wärmekraftmaschine ist also durch thermodynamische Gesetzmäßigkeiten begrenzt. Ein Beispiel: Wird die Maschine zwischen 100 und 200 Grad Celsius betrieben, dann liegt der maximal erreichbare Wirkungsgrad bei rund 21 Prozent (die Temperaturwerte müssen in der Einheit Kelvin in die Formel eingesetzt werden).
Aus der Energieerhaltung und dem zweiten Hauptsatz der Thermodynamik lassen sich auf mathematischem Weg auch noch zwei weitere nützliche Erkenntnisse ableiten: Wärme kann nur dann von einem kalten auf einen warmen Körper übergehen, wenn Arbeit aufgewendet wird – Kühlschränke und Wärmepumpen benötigen eine Energiezufuhr. Zweitens lässt sich mit einem Wärmereservoir konstanter Temperatur keine Arbeit verrichten. Dazu ist immer der Fluss von Wärme zwischen Reservoirs unterschiedlicher Temperatur notwendig.
Der Begriff Entropie ist eine Neubildung durch Rudolf Clausius aus griechischen Wörtern und bedeutet übersetzt ungefähr „Wandlungsgehalt“. Laut dem Physiker hängt die Entropieänderung ΔS eines Systems folgendermaßen mit der zugeführten Wärme und der Temperatur zusammen:
\(\Delta S = \frac{\Delta Q}{T}\)
Dabei bezeichnet ΔQ eine kleine, dem System reversibel zugeführte Wärmemenge und T die Temperatur, die bei dieser Übertragung herrscht. Die Formel besagt, dass zusammen mit Wärme immer Entropie übertragen wird. Boltzmanns Definition der Entropie beruht auf dem Verständnis der Wärme als ungeordnete Bewegung von Atomen oder Molekülen. Ihm zufolge ist die Entropie S durch folgende Formel gegeben:
\( S = k \ln W \)
Die Entropie ist also proportional zum Logarithmus der Zahl W der „Mikrozustände“ eines Systems, wobei alle anderen Parameter – wie Volumen und Teilchenzahl – konstant sind. Mit den Mikrozuständen sind die Möglichkeiten gemeint, wie die Moleküle oder Atome eines eingesperrten Fluids angeordnet sein können. Die Konstante k ist die Boltzmann-Konstante.
Quelle: https://www.weltderphysik.de/thema/phaenomene-der-thermodynamik/entropie/