Das Phänomen Temperatur
Philipp Hummel

Die Temperatur ist im Alltag stets präsent: beim Kochen, beim Wäschewaschen, beim Blick in den Kleiderschrank, wenn man sich richtig auf das Wetter einstellen will. Unser vertrauter Umgang mit dem Begriff täuscht jedoch darüber hinweg, dass ein recht kompliziertes physikalisches Konzept dahintersteckt. Peter Hänggi von der Universität Augsburg erklärte in unserem Podcast die Physik rund um das Phänomen Temperatur.
Peter Hänggi: „Die Temperaturempfindung, die wir täglich wahrnehmen, ist sehr weit entfernt von der Temperatur, wie sie in der Wissenschaft – insbesondere in der Naturwissenschaft – wirklich streng eingeführt wird und mit der man definitionsmäßig weiterarbeiten kann.“
Die Temperatur lässt sich mikroskopisch als die mittlere Energie der atomaren oder molekularen Bestandteile eines Gases, einer Flüssigkeit oder eines Festkörpers auffassen. Schwingen oder bewegen sich die Teilchen schneller, herrscht eine höhere Temperatur, sind sie langsamer, ist sie niedriger. Will man genauer wissen, was eigentlich Temperatur ist, benötigt man weitere zentrale thermodynamische Begriffe wie intensiv und extensiv, Wärme und Entropie.
Der Unterschied zwischen extensiven und intensiven Größen spielt in der Thermodynamik eine wichtige Rolle. Die Begriffe lassen sich am Beispiel von Badewasser erklären. Wärme oder genauer Wärmeenergie ist eine extensive Größe: Bringt man zwei Systeme zusammen – man kippt beispielsweise das Wasser zweier Badewannen in eine doppelt so große –, so addieren sich deren Wärmemengen. Eine doppelt so große Menge an Badewasser enthält auch die doppelte Menge an Wärmeenergie. Bei intensiven Größen wie der Temperatur bildet sich hingegen ein Mittelwert. Die Temperatur des Badewassers liegt am Ende zwischen den Ausgangstemperaturen, wenn man das Wasser mischt. Falls die Temperatur des Wassers in den Wannen gleich war, so bleibt sie also erhalten, wenn man das Wasser zusammenschüttet.
„Deshalb gibt es eigentlich immer in der thermodynamischen Energiebilanz eine Größe, die mit der Systemgröße größer wird. Und die nennt man dann extensiv, wie Volumen, Teilchenzahl oder Magnetisierung. Ein großes Eisen hat eine größere Magnetisierung als ein kleines Eisen. Was in der Thermodynamik wichtig ist: dass zu jeder extensiven Größe eine so genannte konjugierte Größe gehört. Sie dürfen die jetzt aber nicht vermischen, die müssen immer zusammen passen! Und im Fall der Wärme ist es die Entropie und die Temperatur, denn die Entropie-Änderung im Gleichgewicht mal der Temperatur ergibt den Energieinhalt, was wir als Wärme bezeichnen.
Die Entropie, von der Hänggi spricht, ist eine extensive Größe, und ein Maß dafür, wie frei sich Moleküle und Atome anordnen können. Je nachdem, wie viele Möglichkeiten es für die Teilchen in einem Gas oder einer Flüssigkeit gibt sich anzuordnen, ist die Entropie größer oder kleiner. Da sie jedoch nicht direkt messbar ist, bleibt sie recht unanschaulich.
„Die Entropie ist ein Begriff, der wahnsinnig stark verbogen und auch in falschem Zusammenhang von Philosophen und Medizinern eingeführt wurde, wo er aber nichts mehr mit der Bedeutung in der Thermodynamik zu tun hat. Es gibt keinen Begriff, den die Leute so schnell in den Mund nehmen, ohne zu wissen, wovon sie reden.“
Das Fundament der Wärmelehre bilden die Hauptsätze der Thermodynamik. Im sogenannten Nullten Hauptsatz wird die Temperatur als Gleichgewichtszustand zweier Systeme, die Wärme austauschen können, definiert. Der Erste Hauptsatz sorgt für die Erhaltung der Gesamtenergie eines Systems. Der Zweite besagt – in der Formulierung seines Entdeckers Rudolf Clausius –, dass es „keine Zustandsänderung gibt, deren einziges Ergebnis die Übertragung von Wärme von einem Körper niederer auf einen Körper höherer Temperatur ist.“ Daraus ergibt sich auch, dass die Entropie in einem geschlossenen System nie abnehmen kann. Der Zweite Hauptsatz schließt damit zum Beispiel ein Perpetuum mobile aus, dass – einmal in Gang gesetzt – ewig in Bewegung bliebe. Der Dritte Hauptsatz schließlich ist quantenmechanischer Natur und besagt, dass der absolute Temperaturnullpunkt nie erreicht werden kann.
„Der erste Hauptsatz der Thermodynamik ist wie eine Energiebilanz, ein Buchhalter, der schaut, was positiv und was negativ ist. Man summiert Energien auf, und die Energie muss erhalten bleiben. Und der zweite Hauptsatz, der mit der Entropie genauer formulierbar ist à la Clausius, sagt eher, welche Prozesse natürlich und welche unnatürlich sind. Das ist nicht wie bei einem Buchhalter, sondern mehr wie bei einem Direktor, der sagt, wo es langgeht. Sie müssen wissen, dass die Wärme eigentlich immer von warm nach kalt fließt. Unmöglich ist es, von kalt nach warm zu fließen. Das ist eben eine Richtungsaussage.“
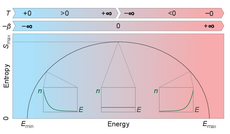
Anfang Januar sorgte eine Veröffentlichung in der Fachzeitschrift „Science“ für Aufsehen. Forscher aus München behaupteten, sie hätten in ihrem Labor ein Gas mit negativer Temperatur erzeugt – das wäre gemäß dem Dritten Hauptsatz der Thermodynamik aber ausgeschlossen. Normalerweise haben die einzelnen Moleküle eines Gases sehr unterschiedliche Energien – von ganz langsam bis sehr schnell. Zustände niedriger Energie sind dabei wahrscheinlicher als solche mit hoher Energie – nur wenige Teilchen bewegen sich also sehr schnell. Diese Verteilung wird in der Physik Boltzmann-Verteilung genannt. Bei null Kelvin – dem absoluten Temperatur-Nullpunkt, der nach dem Dritten Hauptsatz unerreichbar ist – müssten alle Teilchen ruhen.
Den Physikern in München ist es nun gelungen, in ihrem Gas die Boltzmann-Verteilung umzukehren: Viele Teilchen wiesen eine hohe Energie auf und nur wenige eine niedrige. Diese Umkehrung der Energieverteilung deuteten die Forscher als negative absolute Temperatur, denn die Definition der absoluten Temperatur beruhe auf der Verteilung der Bewegungsenergie der Gasatome. Weil diese Verteilung im Verhältnis zum Normalfall umgedreht war, ergab sich per definitionem eine negative Temperatur. Das Gas sei dabei aber nicht kälter als null Kelvin, sondern sogar heißer als bei jeder beliebigen positiven Temperatur – die Temperaturskala höre bei unendlich nicht auf, sondern springe zu negativen Werten. Peter Hänggi bereitet diese Interpretation des Experiments Bauchschmerzen.
„Die Messungen und die Ergebnisse dieser Gruppen sind wahnsinnig gut und wirklich fantastische neue Physik. Dann ist die Frage: Wie nenne ich das? Welchen Namen gebe ich? Und dann kann man eben zeigen, wenn man dieses System untersucht, mit dem Rahmen der thermodynamischen Postulate, dass eine effektive Temperatur diese Messgrößen beschreibt, aber diese Messgröße ist nicht die Größe, die man in der Thermodynamik als absolute Temperatur einführt. In diesem ganz speziellen Fall.“
Manche Experten sehen am Grund der Kontroverse ein rein sprachliches Problem. Für Peter Hänggi liegt der vermeintliche Fehlschluss aber tatsächlich in einer unterschiedlichen Deutung der Physik. So hält das „alte“ Feld der Thermodynamik immer noch Raum für Überraschungen in der aktuellen Forschung bereit.
Quelle: https://www.weltderphysik.de/thema/hinter-den-dingen/das-phaenomen-temperatur/