„Die Entropie von Staub“

Frank Wieben
Mithilfe der Thermodynamik beschreiben Wissenschaftler physikalische Systeme, die aus sehr vielen Teilchen bestehen – wie etwa Gase oder Flüssigkeiten. So lassen sich beispielsweise die Funktionsweisen von Kühlschränken oder Verbrennungsmotoren verstehen. Obwohl seit über hundert Jahren bekannt, sind einige fundamentale Größen der Thermodynamik kaum experimentell bestimmbar. Eine dieser Größen – die Entropie – konnten Dietmar Block und Frank Wieben von der Universität Kiel nun mithilfe von Staubpartikeln direkt messen. Wie das gelang, berichtet Dietmar Block im Interview mit Welt der Physik.
Welt der Physik: Was ist Entropie?
Dietmar Block: Entropie ist – ähnlich wie Energie – eine sehr nützliche Größe, mit der Wissenschaftler physikalische Systeme beschreiben. Der Physiker Ludwig Boltzmann hat die Entropie über das mikroskopische Verhalten eines Systems – also über das Verhalten der einzelnen Bestandteile – definiert. So hängt beispielsweise die Entropie eines Gases von der Bewegung der einzelnen Atome oder Moleküle in dem Gas ab. Würden sich alle Teilchen gleich bewegen – beispielsweise in Form einer Schwingung –, wäre das System in einem sehr geordneten Zustand. Ein solcher Zustand kommt sehr selten vor und hat eine niedrige Entropie. Viel häufiger bewegen sich die Teilchen eines Systems ungeordnet. Dieser Zustand ist leichter zu erreichen und hat eine höhere Entropie. Vereinfacht gesprochen kann man in vielen Fällen die Entropie als ein Maß für Ordnung auffassen.
Warum ist die Entropie eine so wichtige Größe?
Das Besondere an dieser physikalischen Größe ist, dass sie in einem abgeschlossenen System nie abnimmt. Diese Eigenschaft der Entropie ist auch als zweiter Hauptsatz der Thermodynamik bekannt. Damit lässt sich erklären, warum manche Prozesse in der Natur vorkommen und andere nicht: Vergrößert man etwa den Behälter eines Gases, wird sich das Gas in dem gesamten Behälter ausbreiten. Den umgekehrten Prozess allerdings – dass sich das Gas wieder in den ursprünglichen kleinen Raum zurückzieht – wird man nie beobachten. Dadurch würde sich nämlich die Entropie des Systems verringern. Von allen energetisch möglichen Prozessen können nur die beobachtet werden, bei denen die Entropie zunimmt. Diese Prozesse sind damit auch nicht umkehrbar. So gibt es beispielsweise kein Perpetuum Mobile, also eine Maschine, die sich ohne weitere Energiezufuhr von außen von alleine bewegen kann.
Womit haben Sie sich nun beschäftigt?
Obwohl die Entropie eine so zentrale Größe ist und wir mit ihrer Hilfe zahlreiche thermodynamische Prozesse bereits gut beschreiben können, entzieht sie sich einer Messung auf mikroskopischer Skala. Denn Flüssigkeiten oder Festkörper bestehen aus mehreren Hundert Trilliarden Atomen oder Molekülen – viel zu viele, um sie einzeln zu untersuchen. Daher betrachtet man in der Thermodynamik meist nur sogenannte makroskopische Größen, wie etwa das Volumen oder die Temperatur eines Systems. Unser Ziel war es, von Boltzmanns Definition der Entropie auszugehen und in unserem Modellsystem die fundamentalen thermodynamischen Prinzipien zu untersuchen und insbesondere die Entropie auf mikroskopischer Skala direkt zu messen.
Wie haben Sie das gemacht?
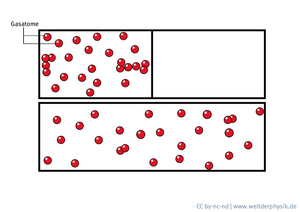
Anstatt uns einzelne Atome oder Moleküle direkt anzuschauen, haben wir das Verhalten eines Modellsystems untersucht. Dazu dienten uns Staubpartikel in einem ionisierten Gas – einem sogenannten Plasma, das aus negativ geladenen Elektronen und positiv geladenen Ionen besteht. Durch die Elektronen im Plasma werden auch die Staubpartikel elektrisch aufgeladen – bis sie eine Ladung von etwa 10 000 Elektronen tragen und sich gegenseitig abstoßen. Sperrt man diese geladenen Partikel in einem elektrischen Feld ein, lassen sich viele dynamische Prozesse beobachten, die genauso wie in Flüssigkeiten oder Gasen ablaufen. Doch anstelle der hundert Trilliarden Atome oder Moleküle besteht unser Modellsystem nur aus wenigen Hundert Teilchen. Außerdem sind die Staubpartikel mit einigen Mikrometern groß genug, um sie mit einem Makroobjektiv und einer Kamera zu filmen. Entropie wird damit in diesem System mikroskopisch messbar.
Was haben Sie sich mit diesem Modellsystem angeschaut?
Wir können mit unserem Modellsystem nicht nur das Verhalten der Mikropartikel beobachten, wir können ihr Verhalten auch beeinflussen. Wenn wir etwa die Staubpartikel mit Laserlicht bestrahlen, geben die Lichtteilchen einen Teil ihres Impulses ab und verändern so die Geschwindigkeit der Staubpartikel. Wir können die Laser so einstellen, dass sich die Staubpartikel wie Atome in einem normalen Gas bei einer vorgegebenen Temperatur bewegen. So können wir uns anschauen, wie sich die Teilchen bei verschiedenen Temperaturen verhalten und jeweils die Entropie des Systems messen.
Was haben Sie dabei herausgefunden?
Unsere Messergebnisse stimmen sehr gut mit den Werten überein, die man theoretisch erwarten würde. Wir liefern damit den Beweis, dass unser Modellsystem den Gesetzen der Thermodynamik gehorcht. Davon ausgehend können wir uns jetzt komplexere Systeme anschauen, deren theoretische thermodynamische Beschreibung bislang noch nicht experimentell überprüfbar war.
Welche Fragen wollen Sie mit Ihrem Experiment noch untersuchen?
Bisher können wir vor allem einfache Systeme im thermodynamischen Gleichgewicht gut beschreiben – etwa Systeme, in denen überall die gleiche Temperatur herrscht. Doch indem wir die Laser anders einstellen, können wir gezielt Systeme erzeugen, die sich nicht im Gleichgewicht befinden. Damit können wir zukünftig theoretische Vorhersagen für diese Art von Systemen überprüfen. Eine weitere spannende Frage ist, wie klein ein System sein darf, damit es sich noch mit den Gesetzen der Thermodynamik beschreiben lässt. In beiden Fällen erforschen wir die Grenzen unserer physikalischen Modellvorstellungen.
Quelle: https://www.weltderphysik.de/gebiet/materie/die-entropie-von-staub/