Was lässt Akkus in Flammen aufgehen?
Franziska Konitzer

Lithiumionen-Batterien sind milliardenfach in Smartphones, Laptops und elektrischen Autos verbaut. Man schätzt sie vor allem wegen ihrer hohen Energiedichte. Doch Lithiumionen-Akkus sorgten in den vergangenen Jahren auch immer wieder für negative Schlagzeilen: Bilder zeigen schmorende Laptops und ausgebrannte Smartphones. Was passiert im Inneren eines „durchbrennenden“ Akkus – und lässt sich das verhindern?
Seit sie Anfang der 1990er-Jahre erstmals in Videokameras zum Einsatz kamen, haben Lithiumionen-Akkus einen weltweiten Siegeszug angetreten: Heute werden jährlich mehrere Hundert Millionen solcher Akkus in Smartphones und Laptops verbaut, aber auch in Elektroautos und Flugzeugen sind sie zu finden. „Die Lithiumionen-Technologie ermöglicht eigentlich überhaupt erst Smartphones und Laptops“, sagt Egbert Figgemeier von der RWTH Aachen. „Im Vergleich zu anderen Akkus haben sie mit Abstand die höchste Energiedichte.“
Diese Leistungsfähigkeit kann aber auch zum Nachteil werden, wenn im Inneren der Batterie ein Kurzschluss auftritt. Es kommt zwar nur sehr selten dazu – von Milliarden Akkus sind nur wenige Dutzend betroffen – doch gehen immer mal wieder Bilder von geschmolzenen oder sogar explodierten Lithiumionen-Akkus durch die Medien.
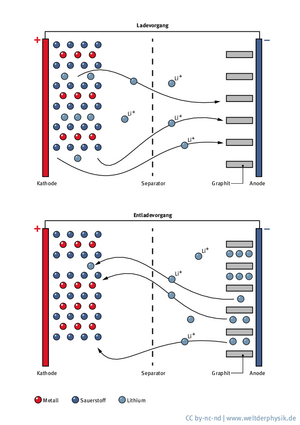
Das Innere eines Lithiumionen-Akkus
Lithiumionen-Akkus bestehen genau wie andere Batterien aus zwei Elektroden. Der Minuspol, die Anode, und der Pluspol, die Kathode, sind durch einen sogenannten Separator voneinander getrennt, der für Lithiumionen durchlässig ist. Der Raum zwischen den Elektroden ist zusätzlich mit einem Elektrolyt gefüllt. Der Elektrolyt ist eine Flüssigkeit, durch die sich die Lithiumionen zwar möglichst frei bewegen sollen, die jedoch keinen Strom leitet.
In einem frisch aufgeladenen Smartphone oder Laptop befindet sich das Lithium anfangs in Form von elektrisch neutralen Lithiumatomen an der Anode. Das Anodenmaterial besteht aus Graphit, in dem das Lithium eingelagert ist. Verbrauchen Handy oder Computer nun Strom, passiert Folgendes: Im Inneren der Batterie wandern die Lithiumionen durch den Elektrolyt und den Separator hindurch zur Kathode und werden dort wieder eingelagert. Das Anodenmaterial gibt währenddessen Elektronen ab, die über den äußeren Stromkreis ebenfalls zur Kathode fließen.
Beim Ladevorgang läuft dieser Prozess umgekehrt ab: Da nun eine Spannung anliegt, die größer ist als die Spannung, die in der Batterie herrscht, wandern die Lithiumionen wieder zur Anode und werden dort eingelagert. „Die Batterie ist geladen, weil das Lithium an der Anode auf einem höheren Potenzial vorliegt“, erklärt Figgemeier. Man muss also Energie aufbringen, um das Lithium von der Kathode zur Anode zu bringen – umgekehrt wird Energie freigesetzt. Lithiumionen eignen sich so besonders gut, weil sie ein besonders großes Potenzial in der Batterie erzeugen können, nämlich rund vier Volt. Bei anderen Batterien sind diese Potenziale nicht so hoch. „Bei einer so hohen Energiedichte kann auch grundsätzlich mehr Energie frei werden. Das Schlimmste, was einem passieren kann, ist der Kurzschluss bei vier Volt.“
Ein Kurzschluss tritt auf, wenn zwischen Kathode und Anode ein unkontrollierter elektrischer Strom fließt, weil die Spannung zwischen den beiden Polen auf nahezu Null abfällt – etwa, weil sich die beiden Elektroden berühren oder weil eine metallische Verbindung zwischen ihnen besteht. „Dann kann innerhalb sehr kurzer Zeit sehr viel Energie sehr punktuell frei werden. Die Temperatur steigt an diesen Stellen extrem an und der Akku kann sich derart aufheizen, dass die Zündtemperatur des organischen Elektrolyten überschritten wird“, beschreibt Figgemeier den Vorgang. „Wenn das passiert, geht es erst richtig los, weil sich der Elektrolyt massiv zersetzt, wodurch noch mehr Energie frei wird, und er wird zusätzlich auch noch mit Sauerstoff aus der Kathode versorgt, der dort intern frei wird. Der Sauerstoff wird als Brennmaterial quasi gleich mitgeliefert.“ Diese Kette von Ereignissen lässt den Lithiumionen-Akku schließlich in Flammen aufgehen oder sogar explodieren.
Kurzschluss hat verschiedene Ursachen
„So ein interner Kurzschluss kann verschiedenste Ursachen haben“, erzählt Figgemeier. „Vor einigen Jahren sind beispielsweise ein paar Dutzend Laptops abgebrannt. Da hat es wohl Verunreinigungen bei der Produktion gegeben, sodass irgendwo Metallspäne mitverarbeitet worden und so in die Zellen gelangt sind. Diese können den Separator durchstechen.“ Neben solchen Verunreinigungen bereitet manchmal auch das Lithium selbst Probleme – und zwar, wenn es nicht einzeln eingelagert im Elektrodenmaterial, sondern verbunden als metallisches Lithium vorliegt. Diese Form von Lithium leitet den elektrischen Strom und kann dadurch einen Kurzschluss verursachen: Es wirkt wie eine Brücke zwischen den beiden Elektroden.
Besonders schwerwiegend kann dieses Problem in sogenannten primären Lithiumbatterien werden, die eigentlich nur für den einmaligen Gebrauch bestimmt sind. „Solche Lithiumprimärbatterien kommen beispielsweise in Hörgeräten zum Einsatz“, berichtet Figgemeier. „Die Anode besteht hier nicht aus Graphit, sondern direkt aus einer Lithiumfolie. Wenn man diese Lithiumfolie wieder aufladen würde, also Lithium darauf abscheidet, dann bilden sich sogenannte Dendriten. Das sind dünne Fäden aus metallischem Lithium, die immer weiter wachsen. Die Dendriten durchschlagen den Separator und verursachen einen Kurzschluss. Das ist im wahrsten Sinne des Wortes brandgefährlich.“
In Lithiumionen-Batterien sind die Lithiumionen zwischen den Graphitschichten eingelagert, wodurch das Wachstum von metallischem Lithium unterbunden wird. „Aber in der Natur ist nichts perfekt“, sagt Figgemeier. „Unter falschen Lade- und Entladebedingungen und bei falschen, beispielsweise sehr tiefen, Temperaturen, kann es eben doch vorkommen, dass auch in Lithiumionen-Akkus metallisches Lithium entsteht und ganz langsam seine Fühler auf die andere Seite ausstreckt.“ Die Verbindung zwischen den beiden Elektroden ist hergestellt, schlagartig fließt Strom und das Handy fängt an zu brennen.
Das Risiko steigt auch, weil Hersteller heutzutage möglichst dünne Handys bauen möchten und deshalb die Akkuzellen immer weiter verdichten. „Man hat zwanzig Jahre lang versucht, immer dünnere Zwischenräume zwischen Anode und Kathode zu bauen, mit immer dünneren Separatoren, und auch die Elektroden wurden immer weiter verdichtet. Doch irgendwann gibt es physikalische Grenzen“, erläutert Figgemeier.
Hersteller arbeiten bereits daran, die Akkus durch einen verbesserten Aufbau noch sicherer zu machen. So könnten beispielsweise keramikbeschichtete Separatoren für eine robustere Isolierung sorgen. Eine andere Idee ist, den organischen Elektrolyten durch Polymere zu ersetzen. Grund zur Sorge bestehe laut Figgemeier aber auch mit den jetzigen Lithiumionen-Akkus nicht. Schließlich gibt es weltweit Milliarden von Lithiumionen-Batterien, die einwandfrei funktionieren, im Vergleich zu den wenigen Dutzend, die ab und zu Schlagzeilen machen. „Die Lithiumionentechnologie bietet sicherlich noch Potenzial für Verbesserungen, vor allem was die verwendeten Materialien betrifft“, so Figgemeier. „Und sie lässt sich sicher handhaben, wenn man die Grenzen nicht bis zum Äußersten ausreizt.
Quelle: https://www.weltderphysik.de/thema/hinter-den-dingen/was-laesst-akkus-in-flammen-aufgehen/