„Radikaler Schritt in der Geschichte der Mikroskopie“
Franziska Konitzer
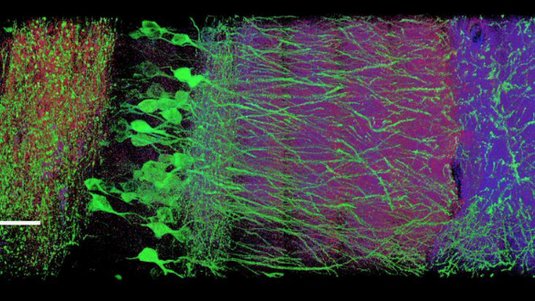
Für das Austricksen der optischen Beugungsgrenze erhielt Stefan Hell 2014 den Nobelpreis für Chemie: Die von ihm entwickelte STED-Mikroskopie umging erstmals geschickt die räumliche Beugungsgrenze von rund zweihundert Nanometern und erlaubte so, Biomoleküle oder Strukturen in Zellen bis auf wenige Nanometer aufzulösen. Dabei basiert das STED-Verfahren auf dem gezielten An- und Ausschalten fluoreszierender Moleküle. In der Praxis konnten diese Methoden allerdings selten eine bessere Auflösung als zwanzig Nanometer erreichen. Die Forschergruppe um Stefan Hell stellte im Fachmagazin „Science“ nun ein neues Konzept namens MINFLUX vor, das die ultimative Grenze routinemäßig erreicht. Es kann einzelne Moleküle optisch voneinander trennen, auch wenn diese nur um einen bis zehn Nanometer voneinander entfernt sind. Welt der Physik sprach darüber mit Stefan Hell vom Max-Planck-Institut für biophysikalische Chemie in Göttingen.
Welt der Physik: Warum war es mit bestehenden Fluoreszenzmikroskopieverfahren bislang nicht möglich, Auflösungen von wenigen Nanometern zu erreichen?
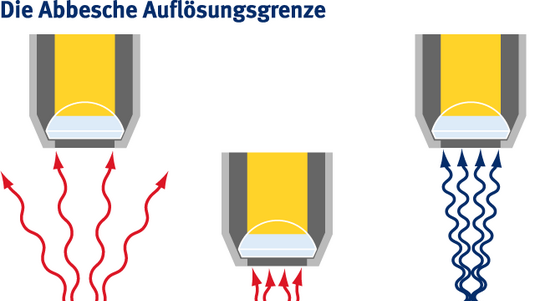
Stefan Hell: Vor zwanzig Jahren war die optische Beugungsgrenze von etwa zwei- bis dreihundert Nanometern das Limit. Sie besagt, dass man Moleküle, die weniger als eine halbe Lichtwellenlänge voneinander entfernt sind, optisch nicht voneinander trennen kann. Man konnte zwar einzelne fluoreszierende Moleküle als solche anhand ihrer Fluoreszenz im Mikroskop wahrnehmen, aber wenn mehrere davon dichter beieinander waren als die Beugungsgrenze, ließen sie sich nicht mehr auseinanderhalten. Die STED-Mikroskopie zeigte als erstes Verfahren, dass man das doch schafft. In der Praxis kam man damit weit – aber eben doch nicht an die ultimative Grenze, nämlich die Auflösung auf molekulare Abstände, heran.
Wie funktioniert die STED-Mikroskopie?
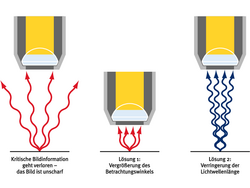
Hat man mehrere Moleküle zu dicht beieinander, so hält man einen Teil der Moleküle davon ab, zu fluoreszieren. Wenn man beispielsweise drei fluoreszierende Moleküle nebeneinander hat, sorgt man bei STED mit einem speziellen „Ausmach-Laser“ dafür, dass zwei von ihnen nicht fluoreszieren. Dann registriere ich das eine noch fluoreszierende Molekül an dem Ort, an dem ich es gefunden habe, und dann mache ich das mit dem nächsten und dem übernächsten und so weiter. Man kann die Moleküle also voneinander trennen, indem man mit dem An- und Ausschalten ihres Leuchtens spielt. Bei STED macht man das normalerweise mit einem donutförmigen Lichtstrahl, den man auf die Probe mit den Molekülen scheint: Der Ring des Donuts ist das Licht, das die Moleküle vom Leuchten abhält, also ihre Fluoreszenz vorübergehend ausmacht, während die Moleküle in einem engen Bereich in seiner Mitte immer noch leuchten können. Dieser Bereich kann sehr klein gemacht werden, sagen wir einmal zwanzig Nanometer, also zehnmal kleiner als bisher. Somit konnten wir erstmals die Schwelle der Beugungsgrenze überschreiten. Prinzipiell kann man diesen Bereich bis auf die Größe eines Moleküls verkleinern. Einige Jahre später wurde ein ähnliches Verfahren entwickelt, dass die Moleküle ebenfalls an- und ausschaltet, um sie voneinander zu trennen. Es nennt sich PALM/STORM.
Was unterscheidet das PALM/STORM vom STED-Verfahren?
Das PALM/STORM-Verfahren schaltet die Moleküle nicht mit einem strukturierten Strahl – wie etwa einem donutförmigen – ein oder aus. Stattdessen sind die Schaltbedingungen so gewählt, dass einzelne Moleküle zufällig an- und ausgeschaltet werden – und zwar irgendwo in der Probe. Man hat also zunächst keine Ahnung, wo genau Moleküle angehen und leuchten. Die Moleküle müssen nur weiter voneinander entfernt sein als die Beugungsgrenze, sodass man sie tatsächlich als einzelne Moleküle betrachten kann. Mit dem An- und Ausschalten erreicht man, dass man eng benachbarte Moleküle voneinander trennen kann. Trennen macht man also wie bei STED mit Fluoreszenz „an“ und „aus“. Jetzt muss man nur noch herausfinden, wo die zufällig verteilten Moleküle liegen. Dazu bildet man die Probe über das Mikroskopobjektiv auf eine Kamera ab, und ein einzelnes leuchtendes eingeschaltetes Molekül verursacht dort einen riesigen Beugungsfleck von Fluoreszenzlicht. Den Mittelpunkt oder „Schwerpunkt“ dieses Beugungsflecks auf der Kamera kann man berechnen und so über die Abbildung auf die Probe zurückrechnen, wo das Molekül in der Probe lag. Diese Schwerpunktberechnung ist umso genauer, je mehr Photonen man von dem Molekül aufgesammelt hat. Wenn das Molekül beispielsweise etwa tausend Photonen an die Kamera abgegeben hat, kann man seine Position auf – sagen wir einmal – vierzig Nanometer genau bestimmen, wenn es fünftausend abgegeben hat, auf zwanzig Nanometer.
Also könnte man diese Genauigkeit prinzipiell bis auf einen Nanometer erhöhen?
Prinzipiell ja, wie bei STED. Aber in der Praxis funktioniert das normalerweise nicht. Man bräuchte viel zu viele Fluoreszenzphotonen von einem einzelnen fluoreszierenden Molekül, sagen wir mal fünfzig- bis hunderttausend. Die meisten Farbstoffmoleküle geben aber nicht Zehntausende von Photonen hintereinander ab, während die anderen alle dabei brav stillhalten. Deshalb kann man mit STED und PALM/STORM normalerweise nur eine räumliche Auflösung von typischerweise rund zwanzig Nanometern erreichen. Und auch das nur mit einer sehr begrenzten Zahl von Farbstoffmolekülarten.
Was war ihr Grundgedanke, um dennoch eine molekulare Auflösung zu erreichen?
Ich habe mir sehr genau überlegt, wie diese beiden Verfahren funktionieren. Sie sind darin gleich, dass das Trennen auf dem An- und Ausschalten der Moleküle basiert, aber wie man an die Position der Moleküle herankommt, ist bei beiden Verfahren total verschieden. Bei STED legt man mit dem donutförmigen Lichtstrahl, der auf die Moleküle einstrahlt, fest, an welcher Stelle die Moleküle leuchten – nämlich in der Mitte des Donuts, sozusagen in seinem Loch. Da ich diese Position kenne, kenne ich auch die Position der Moleküle. Bei PALM/STORM hingegen muss ich die Position des Moleküls herausfinden. Dabei gilt, wie schon gesagt, je mehr Licht ich von einem Molekül messe, desto genauer kann ich seine Position bestimmen. Ich wollte die Stärken von beiden Verfahren kombinieren.
Wie funktioniert das von Ihnen neu entwickelte Verfahren MINFLUX?
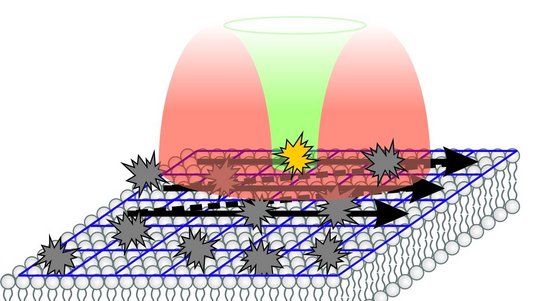
Wir haben das An- und Ausschalten so wie bei PALM/STORM gestaltet: Molekül für Molekül und räumlich zufällig verteilt. Damit ist man – was das Trennen anbelangt – schon auf dem molekularen Level. Um jetzt aber die Position der Moleküle herauszufinden, holen wir vom STED-Verfahren den donutförmigen Lichtstrahl, allerdings schalten wir mit diesem Licht nicht die Moleküle aus, sondern benutzen den Donut, um die angeschalteten Moleküle zum Leuchten anzuregen. Dabei tasten wir das Molekül mit dem Donut ab.
Was passiert dann?
Stimmt beim Abtasten die Position der Donutmitte, also die Nullstelle, mit der Position des Moleküls überein, so wird das Molekül nicht fluoreszieren, weil die Anregungsintensität dort null ist. Dennoch kennen wir die Position des Moleküls dann sehr genau – weil wir wissen, wo wir den Donut hingesetzt haben, dessen Position ist ja von außen elektronisch gesteuert. Man könnte also den Ort des Fluoreszenzmoleküls messen, ohne dass man ein einziges Fluoreszenzphoton einfordert. Das geht natürlich nicht, weil man dazu vorher wissen müsste, wo sich das Molekül befindet. Was der Sache aber sehr nahekommt: Man tastet die Molekülpositionen mit dem Donut ab – in der Hoffnung die zentrale Nullstelle nahe an das Molekül heranzubringen – und misst dabei die Zahl der Photonen, die herauskommen. Wenn es beispielsweise viel weniger werden, ist die Mitte des Donuts näher an der Position des Moleküls und umgekehrt. Mit drei oder vier Fluoreszenzmessungen an bekannten oder vorher festgelegten Positionen des Donuts kann man quasi durch eine Art Triangulation herausrechnen, wo das Molekül ist. Wir brauchen dazu keine Kamera als Detektor, sondern registrieren die Fluoreszenz mit einem ganz normalen Punktdetektor. Auf jeden Fall gilt: Je enger man die Mitte des Donuts an das Molekül heranfährt, desto weniger Fluoreszenzphotonen braucht man, um die Position des Moleküls genau zu bestimmen. Das ist aber nur eine Art und Weise, wie man den Donut zur Positionsfindung eines Moleküls nutzen kann.
Was sind die Vorteile dieses neuen Verfahrens?
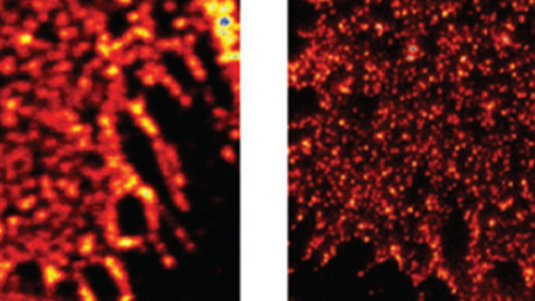
MINFLUX kann mit ein paar Hundert aufgesammelten Photonen schon molekular scharfe Ortsbestimmungen erreichen. In Verbindung mit der Tatsache, dass man mit dem Trennen bereits auf dem Level einzelner Moleküle ist, erreicht man so sehr schnell die echte molekulare Auflösung – also ein Nanometer und damit das ultimative Ende der Auflösung eines Fluoreszenzmikroskops. Deswegen ist MINFLUX ein historischer Durchbruch. Man kann wirklich mit herkömmlichen Optiken Auflösungen auf molekularer Skala erzielen. Wenn wir uns noch an unsere Studienzeit erinnern, in der wir alle lernten, dass bei der halben Wellenlänge Schluss ist, da ist „Auflösung auf Molekülgröße“ schon ein Wort.
Woran haben Sie das neue Verfahren bereits getestet?
Meine Mitarbeiter Klaus Gwosch, Yvan Eilers und Francisco Balzarotti haben Farbstoffmoleküle verwendet, die an DNA festgemacht sind, sogenannte DNA-Origamis. Wir wussten dadurch, dass sich die Moleküle im Abstand von sechs oder elf Nanometern nebeneinander befinden. Und uns ist es gelungen, diese im Bild räumlich scharf voneinander zu trennen. Mit dem PALM/STORM- oder STED-Verfahren wäre eine solche Abbildung ziemlich verwaschen – und mit konventionellen Verfahren kann man das aufgrund der Beugungsgrenze schlichtweg vergessen. Wir haben auch gezeigt, dass man Moleküle in lebenden Bakterien verfolgen kann. Wir haben in lebenden Zellen noch keine hochauflösenden Bilder gemacht, aber auch dafür gibt es keine prinzipiellen Hürden. Das ist nur eine Frage der Zeit.
Was lässt sich mit MINFLUX künftig wissenschaftlich erforschen?
Wir haben die Methode erst einmal mit einem Farbstoff demonstriert, aber es ist klar, dass das mit vielen Farbstoffen funktionieren wird – auch für solche, bei denen STED und PALM/STORM nicht gut funktionieren. Und es ist klar, dass man in der Lage sein wird, die Eigenbewegung von Proteinkomplexen, die nur etwa zehn oder zwanzig Nanometer groß sind, aufzunehmen. Das reicht schon an die Strukturbiologie von Proteinen heran, wie gesagt, in der lebenden Zelle. MINFLUX zeigt wirklich auf, dass die Überwindung der Beugungsgrenze ein wirklich radikaler Schritt in der Geschichte der Mikroskopie war und dieser Schritt wird in den Lebenswissenschaften weitreichende Folgen haben. Speziell MINFLUX wird als das derzeit schärfste Fluoreszenzmikroskopieverfahren eine sehr große Rolle spielen.
Quelle: https://www.weltderphysik.de/gebiet/technik/nachrichten/2016/radikaler-schritt-in-der-geschichte-der-mikroskopie/