Das Bohrsche Atommodell in der heutigen Physik
Vor hundert Jahren entwarf Niels Bohr sein Atommodell, das einen entscheidenden Schritt zur modernen Quantenphysik markierte und heute noch die Forschung inspiriert – etwa bei hochangeregten Rydbergatomen.
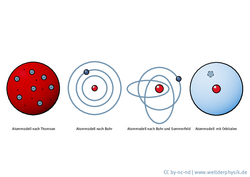
Das Atommodell des dänischen Physikers Niels Bohr, das er ab dem Juli 1913 im „Philosophical Journal“ veröffentlichte, gilt heute als einer der entscheidenden Schritte von der Atomphysik hin zur Quantenmechanik. Anfang des 20. Jahrhunderts war bereits bekannt, dass Atome Elektronen beinhalten, deren negative elektrische Ladung durch eine ebenso große positive Ladung ausgeglichen wird. Eine Zeit lang hielt man deshalb das Atommodell des englischen Physik-Nobelpreisträgers Joseph John Thomson für plausibel: Atome stellen kugelförmige Gebilde dar, die gleichförmig positiv geladen sind und in denen sich die negativen Elektronen gleichmäßig verteilt aufhalten.
Der neuseeländische Physiker Ernest Rutherford, ebenfalls Nobelpreisträger, stellte fest, dass Atome positiv geladene Protonen enthalten. Das Überraschende an seinen Ergebnissen war, dass die Protonen sich im Atom in einem extrem kleinen Volumen konzentrieren, der Durchmesser eines solchen Atomkerns ist um vier bis fünf Größenordnungen kleiner als der des ganzen Atoms. Um diesen positiv geladenen Atomkern mussten in irgendeiner Form die negativ geladenen Elektronen kreisen. Nach den Gesetzen der klassischen Physik unterliegen die Elektronen dann aber Kreisbeschleunigungen, und beschleunigte Ladungen senden Strahlung aus. Dabei müssten sie Energie verlieren und immer enger um den Atomkern kreisen, bis sie schließlich in ihn stürzen. Diese Konsequenz der klassischen Physik steht in völligem Widerspruch zur beobachteten Stabilität der Atome.
Niels Bohr erkannte sehr früh die Eigenheiten dieses Stabilitätsproblems. Bei seinem britischen Kollegen John Nicholson fand er einen interessanten Ansatz. Nicholson hatte einige Spektrallinien der Sonne beobachtet und versucht, die gemessenen Energien mit einem eigenen Atommodell in Einklang zu bringen. Trotz einiger Mängel dieses Modells lag die große Leistung Nicholsons in der Erkenntnis, dass der Bahndrehimpuls der Elektronenbahnen quantisiert sein musste. Der Bahndrehimpuls ergibt sich aus der Geschwindigkeit und der Masse des Elektrons, multipliziert mit seinem Abstand vom Atomkern, um den es kreist. Nach der berühmten Entdeckung von Max Planck, die das Zeitalter der modernen Physik einleitete, kann Energie und Strahlung nur in kleinsten unteilbaren Einheiten, den Quanten, auftreten. Offensichtlich galt dieser Zusammenhang auch für die Bahnbewegung der Elektronen. Sie konnten also nur auf bestimmten Bahnen um den Atomkern laufen.
Das Atommodell nach Bohr und Sommerfeld
Bohr griff diese Idee auf und entwickelte sein Atommodell. Er dachte sich das Atom als punktförmigen, positiv geladenen Kern, um den die Elektronen kreisen wie Planeten um ihren Stern. Um das Problem der Instabilität zu umgehen, führte er eine neue Quantenregel ein: Es sollten nur diejenigen Kreisbahnen erlaubt sein, deren Energieniveaus ganzzahligen Vielfachen des sogenannten Planckschen Wirkungsquantums entsprechen. Zwischen diesen Bahnen kann ein Elektron hin- und herspringen, wenn es Strahlung aufnimmt oder aussendet. Die Energie der Strahlung entspricht dann genau der Energiedifferenz zwischen den Bahnen. Mit dieser Quantenregel gelang es Bohr, die Energieniveaus im Wasserstoff zu berechnen, wie sie sich in den Spektrallinien der Lyman-, Balmer- und Paschen-Serien zeigten. Bei diesen Serien geht ein Elektron unter Aussendung von Strahlung von einem höheren Energieniveau in eines der drei tiefsten Energieniveaus im Wasserstoffatom über.
Der Theoretiker Arnold Sommerfeld erweiterte das Bohrsche Atommodell dann um Ellipsenbahnen, sodass auch vom Bohr-Sommerfeldschen-Atommodell die Rede ist. Dieses Modell stellt einen wichtigen Schritt zwischen den frühen Vorstellungen von Atomen als undurchdringliche Kugeln hin zur modernen Quantenphysik dar. Atome sollten nun also aus mehreren Kügelchen – Atomkernen und Elektronen – bestehen, die sich zwar auf klassisch-physikalisch beschriebenen Bahnen befinden, aber gleichzeitig Quantenbedingungen genügen.
Dieses „semiklassische“ Modell versagte jedoch bei komplexeren Atomen, bei denen im Gegensatz zum Wasserstoff mehrere Elektronen um den Atomkern kreisen. Den Grund dafür konnten die Atomphysiker erst Jahre später mit der Aufstellung der Quantenmechanik angeben: Der Mikrokosmos gehorcht nicht der klassischen Mechanik, wie Bohr noch annahm, stattdessen spielen gänzlich neue quantenphysikalische Gesetzmäßigkeiten und Wechselwirkungen eine Rolle. Der Atomradius, den Bohr mit seinem einfachen Modell für den Grundzustand des Wasserstoffatoms berechnete, stimmt dennoch relativ gut mit dem gemessenen Wert überein. Noch heute wird der sogenannte Bohrsche Atomradius deshalb als Größe in der Atomphysik benutzt. In der Quantenmechanik ordnet man den Elektronen jedoch keine festen Bahnen mehr zu, sondern wolkenförmige Orbitale. Orbitale drücken aus, mit welcher Wahrscheinlichkeit sich ein Elektron an einem beliebigen Ort um den Atomkern aufhält. Das Elektron wird hierbei nicht mehr als punktförmiges Teilchen angesehen, sondern durch eine Wellenfunktion beschrieben.
Forschung mit hochangeregten Atomen
Das Bohrsche Atommodell ist durch die Entwicklungen der Quantenphysik zwar überholt worden, in einigen Fällen wird es trotzdem als Veranschaulichung genutzt. Denn interessanterweise gilt eine Regel, die ebenfalls Bohr als sogenanntes Korrespondenzprinzip in die Quantenphysik eingeführt hatte. Ihr zufolge gleicht sich bei stark angeregten Atomen das Verhalten quantenmechanischer Systeme zunehmend klassisch-physikalischen Systemen an. Je höher ein Atom angeregt ist, desto einfacher lässt es sich durch semiklassische Modelle wie das Bohrsche Atommodell beschreiben
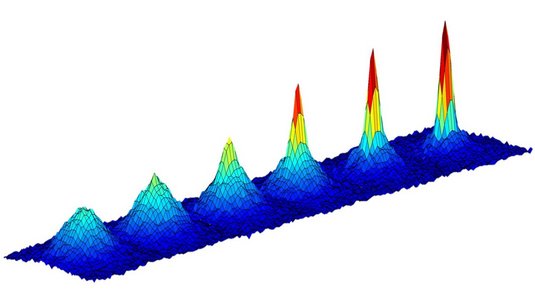
Mittlerweile sind Forscher in der Lage, hochangeregte Atome zu erzeugen, bei denen die Elektronen sich auf extrem weiten Bahnen um den Atomkern bewegen. Zu Ehren des schwedischen Physikers Johannes Robert Rydberg werden solche Atome auch Rydbergatome genannt. Rydbergzustände lassen sich erzeugen, indem Atome mit Licht einer möglichst exakt passenden Energie bestrahlt werden. Die Lichtteilchen heben dann das Elektron aus seinem Grundzustand auf eine sehr hohe Bahn. Dadurch wird es sehr viel empfindlicher für elektromagnetische Wellen.
„Je größer ein Atom ist, desto stärker wechselwirkt es mit elektromagnetischen Wellen wie etwa Licht“, erklärt Tilman Pfau, der an der Universität Stuttgart unter anderem an Rydbergatomen forscht. Der Radius eines Atoms steigt quadratisch mit der Quantenzahl, also der Anzahl der Vielfachen des Planckschen Wirkungsquantums. Ein mit der Hauptquantenzahl von 100 angeregtes Atom ist deshalb 10.000-fach größer als im Grundzustand. Auf solchen hochangeregten Zuständen sehen die Aufenthaltsorte der Elektronen nicht mehr aus wie ein Orbital, wie es bei den tieferen Zuständen noch der Fall ist. Stattdessen ähneln sie den semiklassischen Bahnen des Bohrschen Atommodells.
Die Forscher aus Stuttgart untersuchen die besonderen Verhaltensweisen solcher Rydbergatome, die sie aufgrund ihrer enormen Größe besitzen. Eine von ihnen ist die sogenannte Rydbergblockade. Und zwar besitzt ein Rydbergatom aufgrund seiner Ausdehnung einen solchen Einfluss auf seine atomare Umgebung, dass sich in seiner Nähe kein zweites Rydbergatom bilden kann.
Inzwischen erreichen manche Forschergruppen bei Rydbergatomen Anregungsstufen von 300 bis 500. Diese ultrahoch angeregten Atome sind aber äußerst empfindlich gegenüber äußeren Einflüssen, weil das Elektron in ihnen nur noch sehr schwach gebunden ist. Darum müssen sie außerordentlich gut etwa gegenüber Wärmestrahlung oder elektrischen Feldern abgeschirmt werden.
Dann aber besitzen die Atome einzigartige Eigenschaften. „Rydbergatome sind ausgezeichnete Antennen für elektromagnetische Strahlung“, so Pfau. Und mit diesen Antennen können Forscher etwas bewerkstelligen, das sonst nicht möglich wäre: Ein Rydbergatom wechselwirkt mit sehr hoher Wahrscheinlichkeit mit einem einzelnen Photon. Damit lassen sich Atome und Photonen effizient miteinander verschränken. Bei einer Verschränkung gehen die Teilchen eine besondere quantenphysikalische Verbindung ein.
Rydbergatome und Quantencomputer
Dank dem Phänomen der Verschränkung sind Quantencomputer und Quantenkryptographie denkbar, die bislang ungekannte Möglichkeiten für die Informationsverarbeitung und die Datenübertragung bieten. Die Forschung hierzu steht zwar noch am Anfang, doch Rydbergatome könnten hierbei eine wichtige Rolle spielen. „Es ist mittlerweile möglich, spezielle logische Gatter mit optisch manipulierten Rydbergatomen zu bauen“, sagt Pfau. Solche logischen Gatter sind die Grundbausteine für alle möglichen Rechenoperationen.
Weltweit gibt es mittlerweile eine Reihe von Forschungsgruppen, die unter verschiedenen Aspekten an diesen Problemen arbeiten. Am Max-Planck-Institut für Quantenoptik in Garching befassen sich Wissenschaftler ebenfalls mit Rydbergatomen. Der Arbeitsgruppe von Immanuel Bloch ist es gelungen, Rydbergatome durch gezielte Bestrahlung mit Laserlicht so anzuordnen, dass sich quasi eine kristallförmige Struktur herausbildete. Auch dies ließe sich für logische Gatter in einem Quantencomputer nutzen. „Uns interessiert hierbei insbesondere, wie man die Wechselwirkung gezielt kontrollieren kann, um damit neue Materiezustände zu erzeugen“, erklärt Bloch. Die technischen Möglichkeiten, die diese Grundlagenforschung eröffnet, sind weitreichend. „Wir erforschen deshalb auch die Erzeugung von Vielteilchenzuständen, denn diese sind wichtig für einen leistungsfähigen Quantencomputer“, so Bloch.
Das Bemerkenswerte an den Rydbergatomen ist, dass sie gewissermaßen eine Brücke schlagen zwischen den frühen Anfängen der Atomphysik und der heutigen Hochtechnologie, die auf der Quantenmechanik basiert. Rydbergatome sind gewissermaßen eine besonders deutliche Verkörperung des Korrespondenzprinzips, weil sich an ihnen die klassischen Gesetze und die Quantengesetze gleichermaßen zeigen.
Quelle: https://www.weltderphysik.de/gebiet/teilchen/atome-und-molekuele/atome-und-quantenphysik/das-bohrsche-atommodell-in-der-heutigen-physik/