Rydbergatome
Franziska Konitzer

Ein Atom besteht aus einem Kern und einer Elektronenhülle. Wird mindestens eines dieser Elektronen sehr hoch angeregt, spricht man von einem Rydbergatom. Diese Atome mit ganz besonderen Eigenschaften setzen Forscher wie Tilman Pfau von der Universität Stuttgart unter anderem dazu ein, um ganz neue Arten von Molekülen zu erschaffen.
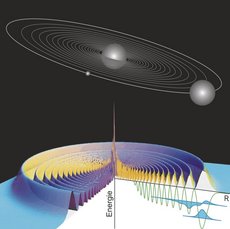
Im Juli 1913 stellte der Physiker Nils Bohr sein Modell eines Atoms vor: Demnach kreisen darin Elektronen um einen punktförmigen, positiv geladenen Kern – wie ein Planet um seine Sonne. Dabei sind allerdings nur bestimmte Kreisbahnen erlaubt, zwischen denen ein Elektron hin- und herspringen kann, wenn es Energie in Form von Licht aufnimmt oder aussendet.
Tilman Pfau: „Das Potenzial eines Kerns auf das Elektron ist ein Coulomb-Potential, das sich ähnlich wie das Gravitationspotenzial zwischen der Sonne und einem Planeten verhält. Je mehr Energie ein Planet hat, desto weiter außen in diesem Potenzial befindet er sich, und desto größer ist seine Umlaufbahn und desto länger ist auch seine Umlaufzeit. Das ist bei den Elektronen nicht anders.“
Dieses semiklassische Bild ist inzwischen überholt und durch ein quantenmechanisches Modell ersetzt worden: Demnach kreisen die Elektronen nicht auf festen Bahnen um den Atomkern, sondern haben nur eine bestimmte Aufenthaltswahrscheinlichkeit, die mit dem Abstand vom Kern abnimmt. Die Bahnen weichen den sogenannten Elektronenorbitalen – Volumen, in denen sich ein Elektron mit einer großen Wahrscheinlichkeit befindet. Eine Ausnahme bilden sogenannte Rydbergatome – sie lassen sich gut mithilfe des Bohrschen Atommodells beschreiben:
„Während normale Atome Größen im Bereich von Angström haben, also zehn hoch minus zehn Metern, können Rydbergatome zehntausend Mal so groß sein, also so groß wie oder noch größer als ein Mikrometer.“
Diese Ausmaße kommen dadurch zustande, dass sich eines der Elektronen in einer sehr weit außen liegenden Bahn beziehungsweise einem sehr hohen Energieniveau befindet. Die Größe des Rydbergatoms spielt auch bei seiner Lebensdauer eine Rolle. Denn wenn ein Elektron auf ein höheres Energieniveau springt, bleibt es in der Regel nur extrem kurz in diesem angeregten Zustand. Danach gibt es die überschüssige Energie wieder ab und kehrt in seinen Grundzustand zurück.
„Normale angeregte Zustände haben Lebensdauern im Bereich von zehn Nanosekunden. Rydbergatome dagegen können zehn Mikrosekunden und in bestimmten Zuständen sogar zehn Millisekunden bestehen. Das liegt ebenfalls an der Größe und daran, dass der spontane Zerfall dadurch behindert wird, dass das Elektron sozusagen nicht mehr zurückfindet in den kleinen Anfangszustand, aus dem es gekommen ist.“
Rydbergatome kommen natürlich vor allem im interstellaren Medium vor: Das diffuse Gemisch aus Gas und Staub ist oft energetisch angeregt. Wenn ein Elektron aus dem Rydbergzustand in einen niedrigeren Energiezustand zurückkehrt, können Astronomen auf der Erde die dabei freigesetzte Strahlung nachweisen.
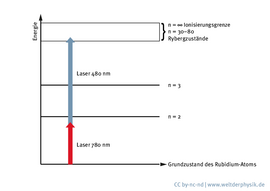
Um ein Rydbergatom künstlich zu erzeugen, muss man dem Elektron eine bestimmte Energiemenge zuführen. Prinzipiell lassen sich alle Atome zu Rydbergatomen anregen. Im Labor verwenden Forscher wie Tilman Pfau und seine Kollegen dazu meist Rubidium.
„Wir nehmen, weil es technisch einfacher ist, zwei Photonen, also zwei Energiepakete, statt nur einem – und zwar ein rotes und ein blaues Photon. Mit diesen beiden Photonen erreicht man fast jeden Rydbergzustand, den man untersuchen möchte – einfach, indem man diese beiden Farben auf Rubidiumgas einstrahlt.“
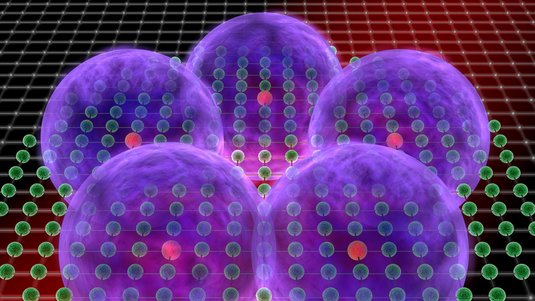
Rubidium eignet sich gut, da sich das äußerste Elektron mithilfe von Lasern leicht in einen Rydbergzustand anregen lässt. Bestrahlen die Forscher allerdings viele, freie Rubidiumatome, also ein Rubidiumgas, mit Laserlicht, wird innerhalb eines Umkreises jeweils nur ein einzelnes Atom zu einem Rydbergatom angeregt. Denn dieses Rydbergatom verhindert, dass auch seine Nachbarn angeregt werden: Sie bleiben also im energetischen Grundzustand.
„Bei einem so großen Atom befinden sich in diesem Atom mehrere andere Grundzustandsatome. Bei einem Rydbergatom mit einer Größe von einem Mikrometer können sich bei einem normalen Gas durchaus tausend normale Atome innerhalb dieses Elektronenorbitals befinden. Die Frage ist: Was passiert in diesem Fall? Schließlich ist es kein leeres Atom mehr, sondern zwischen dem Elektron und dem Kern gibt es jetzt ein Medium aus Grundzustandsatomen.“
Bei Untersuchungen fand das Team um Tilman Pfau heraus: Eines oder auch mehrere dieser Grundzustandsatome binden sich an das Rydbergatom. So entsteht eine ganz neue Art von Molekül, das mit einer Größe von rund einem zehntel Mikrometer größer als manche Viren ist. Dessen Lebensdauer ist zwar auf wenige Millionstel Sekunden begrenzt – danach kehrt das Rydbergatom wieder in den Grundzustand zurück und das Molekül zerfällt. Aber die Forscher konnten eine bislang unbekannte Art der molekularen Bindung bei diesen Rubiudiummolekülen nachweisen.
Rydbergmolekül und Rydbergatom sind sogar so groß, dass sie rein von ihren Ausmaßen her sogar mit optischen Mikroskopen sichtbar gemacht werden könnten – genauer gesagt ihre Elektronenorbitale. Je nach Anregungszustand zieht das Elektron nicht nur Kreise um einen Atomkern. Stattdessen kann es sich in einem kugel-, kegel- oder torusförmigen Bereich um den Kern aufhalten: Aus der Theorie kennen Wissenschaftler die Elektronenorbitale zwar sehr gut – wirklich sichtbar konnten diese bislang aber noch nicht gemacht werden.
„Wir können es noch nicht mit dem optischen Mikroskop sehen, weil es ja nur ein einzelnes, hochangeregtes Elektron ist. Aber das ist tatsächlich eines unserer Forschungsziele: ein Elektronenorbital wirklich unter einem Mikroskop sichtbar zu machen. Ein einzelnes Elektron kann man natürlich so optisch nicht sehen. Man braucht dafür so etwas wie ein Kontrastmittel, das die Elektronendichte sichtbar macht. Dafür wollen wir ein sehr kaltes Gas nutzen.“
Als Kontrastmittel für die Elektronenorbitale wollen Tilman Pfau und seine Kollegen ein Bose-Einstein-Kondensat verwenden. Ein solches Kondensat besteht aus ultrakalten Atomen, die sich wie eine Superflüssigkeit ohne innere Reibung verhalten.
„Wir bringen ein Rydbergatom in ein Bose-Einstein-Kondensat hinein. Dadurch, dass es so kalt ist, spürt es dieses einzelne Elektron und die sehr schwache Wechselwirkung mit diesem Elektron so, dass das ganze Bose-Einstein-Kondensat in das Orbital hineinfließen möchte.“
Das Bose-Einstein-Kondensat kann anschließend mikroskopisch sichtbar gemacht werden, und mit ihm das Elektronenorbital, in dem es sich aufhält. Tilman Pfau rechnet innerhalb des nächsten Jahres mit Ergebnissen: dem ersten echten Blick auf ein Rydbergatom.
Quelle: https://www.weltderphysik.de/gebiet/teilchen/atome-und-molekuele/atome-und-quantenphysik/rydbergatome/