Lithium-Ionen-Batterien
Redaktion

Remigiusz Gora/iStock
Seit sie Anfang der 1990er-Jahre erstmals in Videokameras zum Einsatz kamen, haben Lithium-Ionen-Akkus einen weltweiten Siegeszug angetreten. Inzwischen sind die Batterien milliardenfach in Smartphones, Laptops und Elektroautos verbaut. Man schätzt sie vor allem wegen ihrer hohen Energiedichte.
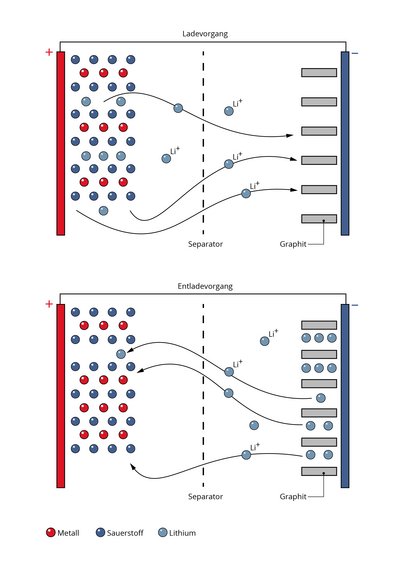
Genau wie andere Batterien bestehen auch Lithium-Ionen-Akkus aus zwei Elektroden. Der Minuspol – die Anode – und der Pluspol – die Kathode – sind durch einen sogenannten Separator voneinander getrennt, der für Lithiumionen durchlässig ist. Der Raum zwischen den Elektroden ist mit einer speziellen Flüssigkeit, Elektrolyt genannt, gefüllt. Sie ermöglicht den Transport der Ionen zwischen Plus- und Minuspol.
In einem frisch aufgeladenen Smartphone oder Laptop befindet sich das Lithium anfangs in Form von elektrisch neutralen Lithiumatomen an der Anode. Das Anodenmaterial besteht aus Graphit, in dem das Lithium eingelagert ist. Verbrauchen Handy oder Computer nun Strom, wandern die Lithiumionen im Inneren der Batterie durch den Elektrolyten und den Separator hindurch zur Kathode und werden dort wieder eingelagert. Das Anodenmaterial gibt währenddessen Elektronen ab, die über den äußeren Stromkreis ebenfalls zur Kathode fließen – und die Geräte auf diesem Weg mit Strom versorgen.
Beim Ladevorgang läuft dieser Prozess umgekehrt ab: Die Lithiumionen wandern wieder zur Anode und werden dort eingelagert. Um das zu erreichen, muss von außen eine Spannung anliegen, die größer ist als die in der Batterie herrschende Spannung – man muss also Energie aufbringen. Weil Lithiumionen ein besonders großes Potenzial in der Batterie erzeugen können, nämlich rund vier Volt, eignen sie sich besonders gut.
2019 erhielten John Goodenough, Stanley Whittingham und Akira Yoshino den Chemienobelpreis für die Entwicklung der Lithium-Ionen-Batterie. Der Grundstein für diesen Batterietyp wurde während der Ölkrise in den 1970er-Jahren gelegt. Whittingham entdeckte ein geeignetes Material für die Kathode der Batterie, die Lithiumionen aufnehmen und wieder abgeben können muss. 1980 schlug Goodenough ein alternatives Material für die Kathode vor, was noch leistungsfähigere Batterien ermöglichte. Auf dieser Grundlage entwickelte Yoshino 1985 die erste kommerziell nutzbare Lithium-Ionen-Batterie.
Anmerkung der Redaktion: Im Februar 2024 haben wir diese Themenseite überarbeitet und aktualisiert. Die ursprüngliche Version erschien im Oktober 2019 auf Welt der Physik.
Quelle: https://www.weltderphysik.de/gebiet/technik/lithium-ionen-batterien/