Qualität sichern, direkt und indirekt

Nur wer die exakte Position des Tumors kennt, trifft bei der Bestrahlung nicht das gesunde Gewebe. Erstmals in der Geschichte lässt sich der Strahl selbst auch in vivo beobachten.
Qualitätssicherung der Strahlapplikation
Um den Strahl sicher im Patienten zu applizieren, ist es wichtig, die Bestrahlungsgeometrie im Patienten genau zu kennen und den Patienten präzise zu lagern – und per Fixierung am Bewegen zu hindern.
Bei der Diagnose des Tumors werden die üblichen bildgebenden Verfahren angewandt, wie Computertomographie (CT) oder Kernspin-Resonanz-Tomographie (Magnetic Resonance Imaging, MRI), um die Größe und Lage des Tumors zu bestimmen und das Zielvolumen festzulegen. Aus dem CT kann auch die Dichte der unterschiedlichen Gewebe errechnet werden und bei geeigneter Kalibrierung für das Bestimmen der Reichweiten der Kohlenstoffionen im Patienten genutzt werden.
Bei der Bestrahlung selbst ist es wichtig, dass der Strahl exakt das Zielvolumen im Patienten trifft. Eine Bestrahlung mit einer räumlichen Verschiebung von auch nur ein bis zwei Millimetern würde einen Teil des Normalgewebes zerstören, und – viel schlimmer – einen Teil der Tumorzellen überleben lassen. Dies würde schnell zum Wiederaufwachsen eines neuen Tumors führen (Rezidiv-Bildung).
Um diese Präzision der Bestrahlung zu gewährleisten, werden individuell für jeden Patienten thermoplastische Masken von der Radiologischen Klinik Heidelberg angefertigt (siehe Abbildung). Diese Masken sind dann fest mit der Patientenliege verbunden und gestatten eine Genauigkeit der Fixierung mittels Laser- und Röntgenkontrolle von einem Millimeter im Kopfbereich und zwei bis drei Millimetern im Körperbereich an der Wirbelsäule und im Beckenbereich. Eine äußere Fixierung im Thorax- und Abdomenbereich ist wegen der Atem- und Herzbewegung mit diesen Hilfen nicht sinnvoll. Eine mögliche Behandlung bewegter Tumoren wird später erläutert.
Für alle Patienten ist diese Fixierungs-Maske die eigentliche körperliche und zum Teil seelische Belastung bei der Schwerionentherapie. Die Maske umschließt den Kopf eng und gestattet keine Bewegungsfreiheit. Das ist der notwendige Sinn der Maske, das Zielvolumen exakt zu positionieren. Die Enge der Maske und die Unbeweglichkeit und Hilflosigkeit wird von allen Patienten, vor allem bei den ersten Bestrahlungen als extreme psychische Belastung empfunden.
Dieses Gefühl lässt im Laufe der Bestrahlungen nach, aber die Fixierungsprozedur mit einer starren Maske bleibt der unangenehmste Teil bei allen Bestrahlungs-Sitzungen. Die Wirkung des Ionenstrahles selbst spürt der Patient nicht. Bei einigen Patienten kam es zu visuellen Leuchtwahrnehmungen, wenn das Zielvolumen in der Nähe des optischen Apparates lag. Dieser „Phospheneffekt“ ist auch aus der Weltraumfahrt bekannt, wenn kosmische Strahlung auf die Sehnerven oder die Retina auftrifft. Er ist sehr schwach und nur bei geschlossenen Augen zu sehen.
Obwohl die äußere Fixierung eine ausreichende Präzision bieten sollte, wird die Lage des Patienten routinemäßig durch Röntgenaufnahmen kontrolliert. Dazu werden mindestens zwei zueinander senkrechte Röntgenaufnahmen des Zielvolumens gefertigt, und an Hand von signifikanten Strukturen wie Knochen und anderen Markern wird die Genauigkeit der Lagerung überprüft. Bei Abweichungen von mehr als einem Millimeter wird der Patient neu positioniert und neu kontrolliert.
Die Positron-Emissions-Tomographie (PET) Analyse
Neben dieser indirekten Methode der Qualitätssicherung der Bestrahlung bieten Ionenstrahlen zum ersten Mal in der Geschichte der Strahlentherapie die Möglichkeit den Strahl im Patienten zu verfolgen.
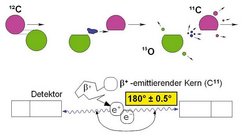
Bei der Passage des Kohlenstoffstrahls durch das Gewebe des Patienten wird durch Kernreaktionen ein kleiner Prozentsatz des ursprünglichen Strahls in leichtere Fragmente umgewandelt (siehe Abbildung).
Die Fragmente mit kleinerer Ordnungszahl, Elemente zwischen Wasserstoff und Kohlenstoff, haben eine größere Reichweite als der primäre Kohlenstoffstrahl und bilden einen Dosisschwanz hinter dem eigentlichen Zielvolumen. Einige der Kernreaktionen führen jedoch nur zu dem Verlust von ein oder zwei Neutronen, also zu den Kohlenstoffisotopen 10C und 11C. Diese Isotope sind instabil und zerfallen mit einer Halbwertzeit von 19 Sekunden beziehungsweise 20 Minuten unter Aussendung eines Positrons und eines Neutrinos, das den Körper verlässt.
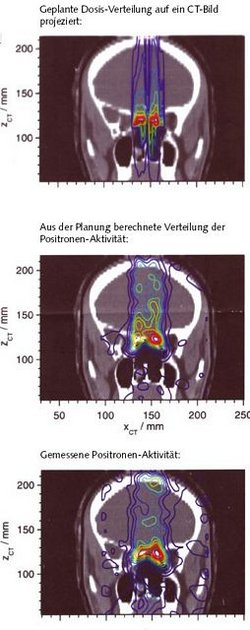
Die instabilen Kohlenstoffisotope 10C und 11C werden fast an derselben Stelle im Patienten gestoppt wie der primäre stabile Kohlenstoffstrahl und zerfallen dort. Der Zerfall der Positronen kann über den Nachweis der dabei entstehenden Gammaquanten von außen mit einer PET-Kamera lokalisiert werden (siehe Abbildung). Damit lässt sich die Reichweite des Strahls im Patienten nachweisen und zwar ohne zusätzliche Dosisbelastung des Patienten und mit einer Genauigkeit, die derzeit bei circa zwei Millimetern liegt.
Die PET-Reichweitenkontrolle, entwickelt vom Forschunszentrum Dresden, ist sehr wichtig bei Bestrahlungen, bei denen Überreichweiten kritische Organe treffen würden. Die PET-Kontrolle hilft aber auch während der Therapie, Veränderungen im Bestrahlungsfeld zu erkennen. Viele Patienten werden vor der Strahlentherapie operiert. Teile des Gewebes können nach der Operation langsam abschwellen. Operationsbedingte Gewebehöhlen können sich mit Schleim oder Wasser füllen. Diese Prozesse verändern die Geometrie des Zielvolumens und verringern damit die Präzision der Bestrahlung. Mit der PET-Analyse lässt sich die Veränderung von Tag zu Tag messen. Bei größeren Abweichungen muss mit einem neuen CT die Bestrahlung neu geplant werden.
So ist es sinnvoll, die PET-Analyse regelmäßig bei jeder Bestrahlung durchzuführen, um sie im Patienten sichtbar zu machen. Auf Grund der gemessenen PET-Daten können die Bestrahlungsdaten verbessert werden. Darüber hinaus beantwortet die PET-Analyse die Frage nach dem Verbleib der Kohlenstoffionen des Primärstrahls.
Mit der PET-Analyse wurde gezeigt, wie sich die implantierten Kohlenstoffatome mit dem überall anwesenden Sauerstoff zu CO2 verbinden. Im üblichen Atmungszyklus wird das CO2 über die Lunge ausgeschieden. Die biologische Halbwertszeit des Kohlenstoffs ist mit circa hundert Sekunden erheblich kürzer als die physikalische Halbwertzeit von etwa zwanzig Minuten. Die Abnahme des gemessenen Signals spiegelt den biologischen Abbauprozess wieder.
Der Abtransport der CO2- Moleküle hängt vom Durchblutungszustand des Gewebes ab. Stark durchblutetes Gewebe wird schnell von den 11C Atomen geräumt. Schlecht durchblutetes Gewebe hält die implantierten 11C Atome länger auf. Damit lässt sich aus dem zeitlichen Auswaschen der PET-Signale auf den Durchblutungsgrad des Gewebes schließen und Informationen über die Reaktionen des bestrahlten Gewebes gewinnen. Wie aufschlussreich diese Information ist und wie weit sie für die weitere Bestrahlung verwendet werden kann, wird die zukünftige Forschung zeigen.
Lesen Sie im folgenden Teil über den Einfluss der Atmung bei der Tumorbestrahlung.
Weiterführende Literatur
Amaldi U., Kraft G.: Recent applications of Synchrotrons in cancer therapy with Carbon Ions. europhysics news,. Vol. 36, No. 4, pp.114-118, 2005
Schulz-Ertner D. et al.: Results of Carbon Ion Radiotherapy in 152 Patients. Int. J. Radiation Onc. Biol. Phys., Vol. 58, No. 2, pp. 631-640, 2004
Nikoghosyan A., Schulz-Ertner D., et al.: Evaluation of Therapeutic Potential of Heavy Ion Therapy for Patients with locally advanced Prostate Cancer. Int. J. Radiation Onc. Biol. Phys., Vol. 58, No. 1, pp. 89-97, 2004
Kraft G.: Tumor Therapy with Heavy Charged Particles. Progress in Part. and Nucl. Phys., Vol. 45, Suppl. 2, pp. S473-S544, 2000
Tumortherapie mit schweren Ionen; Gesellschaft für Schwerionenforschung (Feb.2008)
Quelle: https://www.weltderphysik.de/gebiet/leben/tumortherapie/qualitaet-sichern/