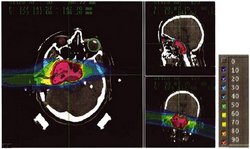
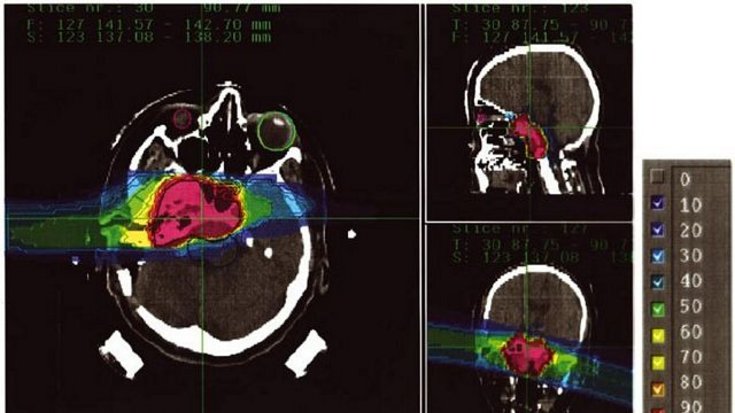
Hochkomplex, aber berechenbar
Inhomogene Verteilungen, Nichtlinearität und andere unregelmäßige Faktoren muss das Rechenmodell der Bestrahlungsplanung berücksichtigen.
Berechnung der Relativen Biologischen Wirksamkeit RBW
Die RBW ist eine komplexe Funktion vieler Parameter wie Dosis, Teilchen-Energie und Ordnungszahl sowie auf der biologischen Seite der Reparaturkapazität und der Zellkerngröße des betroffenen Gewebes.
Für eine korrekte Bestrahlungs-Planung müssen diese Abhängigkeiten in die Berechnung der lokalen RBW-Werte berücksichtigt werden. Dies gilt besonders, wenn der Strahl gescannt wird, also sich die Zusammensetzung des Strahlenfeldes und damit auch die RBW von Punkt zu Punkt ändert. Für die Berechnung einer korrekten RBW über das Bestrahlungsfeld wurde an der GSI das so genannte „Local-Effect-Model“ (LEM) entwickelt, mit dem die Teilchenwirkung aus messbaren Daten ermittelt werden kann.
Grundlage für die erhöhte RBW ist das unterschiedliche Muster der Energiedeposition der Ionen, verglichen mit dünn ionisierender Strahlung. Betrachtet man die Dosis-Verteilung in der Größenordnung eines Zellkerns, also im Mikrometerbereich, dann ist die von Photonen deponierte Dosis homogen über den Zellkern verteilt, während für die Ionen die Dosis auf die Teilchenspur eines jeden Treffers beschränkt bleibt. Bei niederenergetischen Ionen wird ein großer Teil des Zellkerns nicht mit Dosis belegt. Auch innerhalb einer Teilchenspur ist die Dosis nicht homogen verteilt und fällt von der hohen Dosis im Spurzentrum mit einem \(1/r^2\)-Gesetz zum Rand hin ab (\(r\) = Abstand vom Zentrum).
Dieser Verlauf geht über mehrere Größenordnungen mit einer zentralen Dosis von vielen kilo-Gray (kGy) bis zu Bruchteilen von Gray (Gy) am Rande der Spur.
Das „Local-Effect-Model“
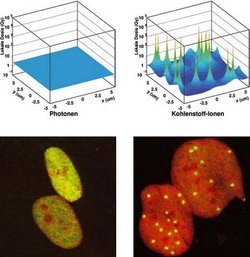
Das Grundprinzip des Local-Effect-Models ist es, die nicht homogene Dosis-Verteilung in der Teilchenspur mit der nichtlinearen Photonen-Dosiseffekt-Kurve zu falten und daraus die Teilchenwirkung zu berechnen.
Dazu wird der Zellkern mit einer Teilchendichte belegt, die der makroskopischen Dosis entspricht (siehe Abbildung). Die physikalischen Parameter, wie Teilchenenergie und Ordnungszahl stecken dann in der radialen Ausdehnung der jeweiligen Teilchenspuren und ihrer Absolutdosis. Für jede Teilchenbelegung ergibt sich entsprechend der radialen Dosis-Verteilung in der Spur eine inhomogene Dosis-Verteilung über dem Zellkern.
Diese inhomogene Dosis-Verteilung wird in kleine Unterbereiche zerlegt, die so klein sind, dass die Dosisschwankung in den Untervolumen klein ist gegen den Absolutwert der Dosis. Für jeden dieser kleinen Bezirke wird aus der Photonen-Dosiseffekt-Kurve die Anzahl von letalen Läsionen, also für die Zelle tödlichen Schäden, berechnet und mit der Größe des Bezirks im Vergleich zur Zellkerngröße gewichtet.
Die Summe der Anzahl von Läsionen der Einzelbereiche ergibt eine Gesamtzahl \(N\). Daraus lässt sich unter der Annahme einer Poissonstatistik das Überleben \(S =\exp{(–N)}\) berechnen. Für viele verschiedene Teilchenbelegungen, das heißt verschiedene Dosen, lässt sich dann eine Dosiseffekt-Kurve konstruieren. Aus dieser Dosiseffekt-Kurve wird dann im Vergleich zu der Röntgenkurve der RBW berechnet.
Der wichtigste biologische Parameter bei dieser Berechnung ist die Form der Photonen Dosiseffekt-Kurven (die Schulter), das heißt das \(\alpha/\beta\)-Verhältnis. Eine Rechnung nach dem LEM ergibt in Übereinstimmung mit den experimentellen Befunden, dass große RBW-Werte mit kleinen \(\alpha/\beta\)-Werten korrelieren und umgekehrt.
Die Gültigkeit des LEM wurde in vielen Zellexperimenten und in Tierexperimenten ebenso bestätigt wie in nicht-biologischen Systemen, wie Thermoluminiszenzdetektoren (TLDs) oder photographischen Filmen, welche eine nichtlineare Wirkungskurve gegenüber ionisierender Strahlung haben. LEM bietet generell die Möglichkeit, die Teilchenwirkung zu berechnen, wenn man die Photonen-Wirkung kennt. Dies lässt sich für eine biologisch optimierte Bestrahlungsplanung ausnutzen. Mit dem Local-Effect-Model lässt sich für jede Zusammensetzung eines Strahlungsfeldes punktweise die lokale RBW berechnen und für die Bestrahlungsplanung verwenden. Dabei ergibt sich über das gesamte Bestrahlungsfeld eine große Variation der RBW, je nach der Strahlenresistenz des Tumors oder Gewebes und je nach der lokalen Dosis. LEM enthält jedoch keine Zeitparameter. In einer protrahierten Bestrahlung, in der viele Schäden während der Bestrahlungszeit repariert werden können, wird LEM die biologische Wirkung überschätzen.
Bestrahlungsplanung und die Berücksichtigung der RBW
Die erhöhte relative biologische Wirksamkeit RBW ist der wichtigste Grund, schwerere Ionen – wie Kohlenstoffionen – für die Tumortherapie zu benutzen. Nur durch die schweren Ionen kann die hohe Reparaturfähigkeit von resistenten Tumorzellen ausgeschaltet werden. Allerdings muss die RBW in die Bestrahlungsplanung richtig integriert werden. Wie zuvor gezeigt, hängt die RBW in komplizierter Weise von physikalischen und biologischen Parametern ab und kann nicht mit einem globalen Dosis-Faktor berücksichtigt werden.
Bedingt durch den biologischen Kenntniszuwachs der letzten Jahre und die Verfügbarkeit von größeren und schnelleren Rechnern kann der Medizinphysiker jetzt die komplexen RBW-Werte berechnen und punktweise in der Bestrahlungsplanung berücksichtigen. Dies war bei Beginn der Teilchentherapie in Berkeley noch nicht möglich, deshalb wurden zunächst einfache Näherungen verwendet. Mit der Einführung neuer Therapien wurde die Bestrahlungsplanung bei der Schwerionentherapie schrittweise verbessert. Bei den Protonen-Therapien hat diese Entwicklung nicht stattgefunden.
Protonen
Für Protonen steigt die RBW nur auf den letzten Millimeter-Bruchteilen der Reichweite an. Dies wurde in Zellexperimenten nach Beginn von klinischen Protonen-Bestrahlungen bestätigt. Für den klinischen Einsatz hatte man zuvor die RBW für ausgedehnte Volumina gemessen und einen Anstieg von zehn bis zwanzig Prozent gefunden.
Deshalb wird bis heute in der Bestrahlungsplanung die absorbierte physikalische Dosis mit einer globalen RBW von 1,1 bis 1,2 multipliziert und die so erhaltene biologisch-effektive Dosis in GyE (Gray equivalent) angegeben. Bei einer tumorkonformen Bestrahlung mit einem Rasterscan-Verfahren mag diese Näherung zu ungenau sein. Dann wird man eine RBW-Variation zumindest näherungsweise in die Planung implementieren müssen.
Schwere Ionen
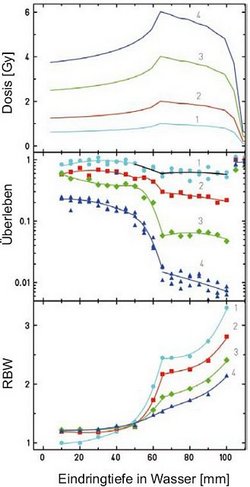
Schwerere Ionen wie Kohlenstoffionen haben eine wesentlich höhere RBW über einen größeren Reichweiten-Bereich. Dies muss in der Planung berücksichtigt werden. Die wichtigsten Abhängigkeiten der RBW von den physikalischen Parametern kann man aus den experimentellen Daten der folgenden Abbildung herleiten. Für ein ausgedehntes Tumorvolumen nimmt die RBW zum distalen Ende, das heißt zur maximalen Reichweite zu, da dort die Dosisanteile im Wesentlichen von Bragg-Maximum-Ionen geliefert werden. Im Bereich nahe der Oberfläche, dem proximalen Teil des Zielvolumens, ist der Anteil von Plateau-Ionen groß und entsprechend ist die RBW kleiner.
Um einen gleichmäßigen biologischen Effekt in der Tiefe zu erreichen, muss man deshalb die physikalische Dosis zum distalen Ende hin absenken. Dies ist in der Abbildung für alle Dosen gezeigt. Ebenso sieht man aber durch den Vergleich der RBW- und Überlebens-Kurven, dass die RBW in ihrem Absolutwert stark von der Dosis abhängt. Für eine hohe Dosis ist die RBW klein, für eine niedrige Dosis groß.
Von älteren Therapeuten, die mit Neutronen arbeiteten, wird oft vorgeschlagen, die RBW für die physikalische Dosis mit einer mikrodosimetrischen Ansprechfunktion zu berechnen. Dieses Verfahren ist prinzipiell nicht unmöglich, aber sehr schwierig. Zunächst sind diese Ansprechfunktionen nicht bekannt. Sie könnten aber prinzipiell für jeden Tumor ermittelt werden. Diese Ansprechfunktionen hängen von der Teilchenenergie und der Ordnungszahl der Ionen ab. Das bedeutet, dass für ein komplexes Teilchenfeld viele Ansprechfunktionen ermittelt werden müssen. Außerdem hängt die Ansprechfunktion von der Dosis ab. Dies heißt, dass der Satz von Ansprechfunktionen um die Zahl der möglichen Dosen erweitert werden müsste. Ohne die prinzipielle Machbarkeit zu diskutieren, ergibt sich bei dem Verfahren der Mikrodosimetrie keine Reduktion der Daten auf eine einfache Abhängigkeit, wie dies bei LEM der Fall ist. Im Gegenteil: für jeden Punkt des Zielvolumens muss für die mikrodosimetrische Methode ein ganzer Satz unterschiedlicher funktionaler Abhängigkeit vorbestimmt werden. Deshalb ist die mikrodosimetrische Bestimmung der RBW für die Planung und Dokumentation der Bestrahlung mit schweren Ionen nicht praktikabel, da sie einen nicht bewältigbaren Aufwand erfordert. Dies wird auch durch die Tatsache unterstützt, dass es bis jetzt nicht gelungen ist, eine einfache Überlebenskurve für in vitro Experimente aus mikrodosimetrischen Daten vorher zu berechnen.
Weiterführende Literatur
Amaldi U., Kraft G.: Recent applications of Synchrotrons in cancer therapy with Carbon Ions. europhysics news,. Vol. 36, No. 4, pp.114-118, 2005
Schulz-Ertner D. et al.: Results of Carbon Ion Radiotherapy in 152 Patients. Int. J. Radiation Onc. Biol. Phys., Vol. 58, No. 2, pp. 631-640, 2004
Nikoghosyan A., Schulz-Ertner D., et al.: Evaluation of Therapeutic Potential of Heavy Ion Therapy for Patients with locally advanced Prostate Cancer. Int. J. Radiation Onc. Biol. Phys., Vol. 58, No. 1, pp. 89-97, 2004
Kraft G.: Tumor Therapy with Heavy Charged Particles. Progress in Part. and Nucl. Phys., Vol. 45, Suppl. 2, pp. S473-S544, 2000
Quelle: https://www.weltderphysik.de/gebiet/leben/tumortherapie/bestrahlungsplan/



![Prinzip des Local-Effect-Models (LEM) Zeichnung von runder Zellkernfläche, überdeckt mit roten Punkten, umgeben von je vielen Kreislinien ("Spuren"). Darüber zwei Kurven, mit Pfeilen zugehörig zu einem Punkt im Zellkern: Links "Radiale Dosisverteilung" (Einheit D(r) [Gy]) aufgetragen gegen Radius in µm), Kurve fällt von 10 hoch 6 in leichtem Konvexbogen ab auf 10hoch minus 6, beim Radius von 10hoch minus 4 auf 100. Rechts die "Photonen-Dosiseffekt-Kurve", (Einheit Sx(D) aufgetragen gegen Dosis (Gy)), Kurve fällt ebenso ab von 1 logarithmis auf 0,001, bei Dosis von 0 bis 14.](/fileadmin/_processed_/c/5/csm_2008_21_PrinzipLEM_MScholzGSIDarmstadt_445820fc01.jpg)