Therapie mit Radiopharmaka
Kerstin Beckert

Radiopharmaka wie das radioaktiv markierte Natriumjodid werden in der nuklearmedizinischen Therapie schon seit mehreren Jahrzehnten verwendet. Sie kommen bei der Behandlung von entzündeten Gelenkschleimhäuten und der Schilddrüsenüberfunktion zum Einsatz, aber auch bei speziellen Formen von Krebs, zum Beispiel in der Schilddrüse und der Bauchspeicheldrüse.
In der nuklearmedizinischen Therapie werden vor allem radioaktive Isotope genutzt, die Betastrahlung abgeben: Sie verfügen über instabile Atomkerne, in denen ein Überschuss an Neutronen besteht. Durch Veränderungen im Atomkern gehen sie in einen stabileren Zustand über, dabei wird Strahlung in Form eines Elektrons freigesetzt (Betateilchen). Diese Betastrahlung ist sehr energiereich und hat im menschlichen Gewebe eine mittlere Reichweite von wenigen Millimetern. In der nuklearmedizinischen Therapie wird sie unter anderem dazu verwendet, um krankes Gewebe wie entzündete Gelenkschleimhäute oder Krebstumore im Körper zu zerstören. Die Patienten bekommen die instabilen Isotope dazu in Form sogenannter Radiopharmaka verabreicht.
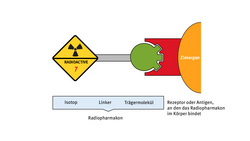
Aufbau eines Radiopharmakons
Radiopharmaka bestehen üblicherweise aus drei Bausteinen: Aus einem radioaktiven Isotop, das messbare Strahlung abgibt, aus einer Trägersubstanz, die am Stoffwechsel des erkrankten Organs beteiligt ist und dort eine wichtige Rolle spielt, und aus einem Linker, der beides chemisch miteinander verbindet. Auf diese Weise wird das radioaktive Isotop wie ein Spion in den Körper eingeschleust, ohne dass der Patient davon etwas bemerkt.
Als Trägersubstanz kommt zum Beispiel Zucker in Frage. Er lagert sich bevorzugt in Tumorzellen ein, da diese durch ihr Wachstum einen erhöhten Zuckerverbrauch haben. Jod kann ebenfalls eine solche Trägersubstanz sein. Es spielt im Stoffwechsel der Schilddrüse eine große Rolle, außerdem sendet es in Form des Isotops Jod-131 Betastrahlung aus. Dadurch fungiert das radioaktive Jod zugleich als Isotop und als Trägersubstanz. Verwendet wird es als Salz in Kapseln – oder in Form des flüssigen Radiopharmakons 131J-Natriumjodid. Dessen Strahlung hat eine Halbwertszeit von rund acht Tagen, eine Zerfallsenergie von 0,971 Megaelektronenvolt (MeV) und eine maximale Reichweite von zwei Millimetern. Durch diese Eigenschaften eignet es sich für die Behandlung von Schilddrüsenerkrankungen besonders gut. Die Halbwertszeit gibt dabei an, in welcher Zeit sich die Menge der aufgenommenen Betastrahlung statistisch gesehen halbieren wird.
Programmierter Zelltod durch Jod
Die Radio-Jod-Therapie gehört zu den häufigsten Verfahren in der Nuklearmedizin. Vornehmlich wird sie bei der Behandlung einer gutartigen Überfunktion der Schilddrüse eingesetzt – oder wenn die Schilddrüse aufgrund einer Krebserkrankung operativ entfernt werden musste. Im Körper versprengte Metastasen lassen sich durch Jod-131 gut behandeln, da es vom Stoffwechsel der Krebszellen weiter aufgenommen wird. Die ausgesendete Betastrahlung beeinflusst das Erbgut der betroffenen Zellen. Diese werden am Wachstum gehindert und können sich nicht mehr vermehren. Allerdings tritt diese Wirkung erst bei der nächsten Zellteilung ein. Daher wirken sich nuklearmedizinische Therapieverfahren in der Regel erst nach einigen Wochen oder Monaten aus.
Für die Zerstörung der kranken Zellen ist im Zielorgan eine gewisse Strahlungsdosis nötig. Angestrebt werden je nach Erkrankung zwischen 150 und 1000 Gray. Anhand der Marinelli-Formel (siehe Infokasten) berechnen Mediziner die Menge an Radioaktivität, die dem Patienten verabreicht werden muss, um im Zielorgan die gewünschte Dosis an Strahlung zu erreichen. Hierbei sind vor allem drei Dinge wichtig: Wie viel Aktivität aus der Testkapsel wird vom Gewebe aufgenommen, wie lange verbleibt das Isotop in der Schilddrüse und wie groß ist das zu bestrahlende Gewebe? Die Testkapsel enthält relativ kleine Mengen des verwendeten Radiopharmakons und soll vermeiden, dass dieses später zu hoch oder zu niedrig dosiert wird.
Das Radiopharmakon verteilt sich nach der Einnahme über die Blutbahn im gesamten Körper. Kurzfristig werden also auch andere, gesunde Zellen mitbestrahlt. Primär reichert sich Jod-131 jedoch aufgrund seiner Eigenschaften fast ausschließlich im Gewebe der Schilddrüse an, um dort zielgenau die erkrankten Zellen zu zerstören. Was sich nicht anreichert, wird innerhalb von 48 Stunden über Nieren, Harnblase und Urin fast vollständig ausgeschieden. Damit dies möglichst schnell geschieht, sollte man nach der Behandlung mit Jod-131 reichlich trinken.
Das Risiko einer zusätzlichen Krebserkrankung wie Leukämie scheint bei der Therapie einer gutartigen Erkrankung der Schilddrüse nicht erhöht zu sein. Bei Schilddrüsentumoren wird jedoch eine deutlich höhere Aktivität verabreicht. Aus diesem Grund erhöht sich das Risiko langfristig um zwei bis drei Prozent. Dies gilt sowohl für die bei Krebserkrankungen häufig durchgeführten Bestrahlungen und Chemotherapien als auch für einige andere nuklearmedizinische Therapien, die zur Behandlung von Tumoren eingesetzt werden.
Dotatoc – Radiopharmakon „imitiert“ Hormon
Eines dieser Verfahren ist die Radio-Peptid-Therapie. Das Radiopharmakon verteilt sich hierbei durch eine Infusion ebenfalls über die Blutbahn im Körper und reichert sich im Zielorgan an. Allerdings besteht es in diesem Fall nicht aus einer natürlichen Trägersubstanz, die zugleich radioaktiv strahlt, sondern aus einer künstlich hergestellten Trägersubstanz, die einen körpereigenen Stoff in seiner Funktion nur „imitiert“. Bei diesem körpereigenen Stoff handelt es sich um das Hormon Somatostatin. Es bindet an ganz spezielle Rezeptoren, die auf das Hormon „zugeschnitten“ sind. Das bedeutet: Das Hormon kann nur an diese Art von Rezeptoren binden und so eine Reaktion im Körper auslösen. Diese Rezeptoren kommen verstärkt auf der Oberfläche der Zellen bei neuroendokrinen Tumoren vor. Das sind spezielle Krebsformen, die vor allem im Bereich der Bauchspeicheldrüse, im Magen-Darm-Trakt und teilweise in der Lunge auftreten.
Der das Somatostatin imitierende Teil des Radiopharmakons wird DOTATOC genannt. Er besteht aus dem chemischen Linker DOTA und der Trägersubstanz TOC. Als radioaktives Isotop kommt Yttrium-90 aufgrund seiner relativ hohen Energie von 2,284 MeV in Frage. Damit verbunden ist eine Reichweite, die im menschlichen Gewebe bis zu elf Millimeter beträgt. Die Halbwertszeit liegt bei drei Tagen. Yttrium-90 bestrahlt dabei das Gewebe in alle Richtungen – dies wird Kreuzfeuereffekt genannt. Allerdings kann sich freies Yttrium-90 in der Niere anreichern und diese schädigen. Bei älteren Patienten wird daher oft das energieärmere Lutetium-177 (0,497 MeV) eingesetzt. Es hat eine Halbwertszeit von fast sieben Tagen und im Gewebe eine Reichweite von ungefähr einem Millimeter.
Fresszellen in der Gelenkschleimhaut
Das Isotop Yttrium-90 wird aufgrund seiner maximalen Reichweite von elf Millimetern auch bei der Radiosynoviorthese (RSO) verwendet. Das ist ein Verfahren, bei dem chronisch entzündliche Gelenkerkrankungen wie die rheumatoide Arthritis behandelt werden. Die Schleimhaut der Gelenke ist hier durch eine chronische Entzündung stellenweise verdickt. Namentlich wird die RSO in der Nuklearmedizin seit dem Jahr 1968 eingesetzt. Für die Therapie stehen drei Isotope zur Verfügung: Yttrium-90 wird vor allem bei größeren Strukturen wie dem Kniegelenk verwendet. Rhenium-186 wird dagegen für die Behandlung der mittelgroßen Gelenke an Ellenbogen oder Hüfte benutzt. Die Reichweite beträgt bei 1,069 MeV knapp vier Millimeter – die Halbwertszeit ist mit fast vier Tagen etwas länger als bei Yttrium. Erbium-169 hat eine noch längere Halbwertszeit, sie beträgt neun Tage. Aufgrund seiner maximalen Reichweite von einem Millimeter wird es vor allem bei Finger- und Zehengelenken eingesetzt (0,34 MeV).
Bei der Radiosynoviorthese wird nur lokal behandelt; das Radiopharmakon wird als Kolloid direkt in das Gelenk gespritzt. Bei einem Kolloid handelt es sich um eine Flüssigkeit, in der sich Teilchen gleichmäßig verteilen – wie Fetttröpfchen in der Milch oder Schmutzteilchen im Schlamm. Bei der RSO wird es häufig aus einem geeigneten Isotop und dem Salz der Zitronensäure zusammengestellt. Nach der Injektion verteilt es sich gleichmäßig in der Gelenkflüssigkeit. Dort wird es von den auf der Oberfläche der Gelenkschleimhaut sitzenden Fresszellen als Fremdkörper erkannt. Fresszellen sind ein Teil der körpereigenen Abwehr. Sie „fressen“ den radioaktiven Eindringling auf, wodurch die Gelenkschleimhaut von innen bestrahlt wird. Dort sterben die kranken Zellen schließlich langsam ab. Allerdings tritt die Wirkung durch den programmierten Zelltod erst nach einigen Wochen ein.
Durch die geringe Reichweite verbleibt die Strahlung in der Gelenkkapsel, muss also nicht aus dem Körper ausgeschieden werden. Auch das angrenzende gesunde Gewebe erreicht sie in der Regel nicht. Bei geeigneter Dosierung stellt die Betastrahlung für gewöhnlich also keine Gefahr für die Umgebung dar, der Patient darf gleich nach der Behandlung nach Hause gehen. Allerdings sollte das Gelenk für mindestens zwei Tage absolut ruhig gestellt werden. Dadurch haben die Fresszellen in der Gelenkschleimhaut ausreichend Zeit, das Radiopharmakon aufzunehmen. Je mehr das Gelenk aber bewegt wird, desto wahrscheinlicher ist ein Abtransport über das Lymphsystem und nachfolgend in andere Organe – wie Leber und Milz.
Strahlenschutz bei der Behandlung
Zum Schutz von Mensch und Umwelt müssen die Patienten bei der Radio-Jod- sowie der Radio-Peptid-Therapie dagegen für mindestens 48 Stunden im Krankenhaus bleiben. Dies schreibt unter anderem die in Deutschland gültige Strahlenschutzverordnung vor. Sie besagt außerdem, dass die vom Patienten über den Urin, den Schweiß und das Duschwasser ausgeschiedene Radioaktivität gesammelt werden muss. Das Wasser wird in speziellen Tanks einer Abklinganlage gelagert, bis die zulässigen Grenzwerte unterschritten sind. Nötig ist dies vor allem wegen der Gammastrahlung, die von einigen Isotopen gleichzeitig mit der Betastrahlung abgegeben wird. Zu den „doppelstrahligen“ Isotopen gehören Jod-131, Rhenium-186 und Lutetium-177.
Werden die Radiopharmaka über eine Injektion verabreicht, kommt auch das Personal mit der Strahlung in Kontakt. Aus Strahlenschutzgründen wird daher eine sogenannte Spritzenhülle als Abschirmung verwendet. Bei Betastrahlern besteht die Hülle aus Plexiglas, da es die freigesetzten Elektronen gut abschirmt. Außerdem ist die Spritze über einen Verbindungsschlauch zum Beispiel mit der Armvene des Patienten verbunden. Bei Isotopen, die zusätzlich noch Gammastrahlung aussenden, gibt es dazu noch eine Abschirmung aus Wolfram oder Blei. Jod-131 kann auch als Kapsel eingenommen werden, die einer gewöhnlichen Medikamentenkapsel sehr ähnlich sieht. Allerdings ist sie oft in der Signalfarbe Orange eingefärbt und wird aufgrund der Strahlung einzeln in einem bis zu zehn Kilogramm schweren Bleibehälter geliefert.
Marinelli-Formel
Die Marinelli-Formel wurde nach dem argentinischen Wissenschaftler Leonidas D. Marinelli (1906 – 1974) benannt. Durch die Formel lässt sich berechnen, wie viel Strahlung bei der nuklearmedizinischen Therapie einer Krankheit zum Einsatz kommen soll. Die Therapieaktivität wird in Megabecquerel (MBq) angegeben. Eine Aktivität von einem Becquerel bedeutet, dass ein radioaktives Atom pro Sekunde zerfällt, bei einem Megabecquerel sind es entsprechend eine Million Atome pro Sekunde.
\( \text{Aktivität (MBq)} = K \cdot \frac{ \text{angestrebte Strahlungsdosis (Gy)}~\cdot~\text{Volumen des zu untersuchenden Organs (ml)}} {\text{maximale Aufnahme im Organ (%, Uptake)}~\cdot~\text{effektive Halbwertszeit}} \)
Die Einheit Gray (Gy) gibt an, wie viel Strahlungsenergie von einem Kilogramm Gewebe aufgenommen wird (in Joule pro Kilogramm). Bei Beta- und Gammastrahlung ist sie mit der Einheit Sievert gleichzusetzen. Letztere berücksichtigt, wie gefährlich die jeweilige Art von Strahlung für den Körper ist.
Bei der Größe K handelt es sich um eine Konstante mit dem Wert 24,67. Die Messwerte werden durch eine Testaktivität bestimmt, die vor der eigentlichen Therapie als Kapsel verabreicht wird. Sie ist deutlich kleiner, als die später verwendete Aktivität – in der Regel im Bereich von ein bis vier MBq. Eine solche Testaktivität wird vor allem bei der Radio-Jod- und Radio-Peptid-Therapie eingesetzt.
Welt der Physik CC by-nc-nd
Quelle: https://www.weltderphysik.de/gebiet/leben/radiopharmaka/therapie-mit-radiopharmaka/