Forschung im HASYLAB

Im Hamburger Synchrotronstrahlungslabor HASYLAB bei DESY arbeiten Naturwissenschaftler verschiedener Fachrichtungen sowie Industrieunternehmen an ganz unterschiedlichen Fragestellungen - von der reinen Grundlagenforschung über anwendungsnahe Untersuchungen bis hin zu speziellen Analysen.
Ein wichtiger Schwerpunkt im HASYLAB ist die Materialforschung, beispielsweise die Entwicklung neuer Kunststoffe, besserer Schweißverfahren, leistungsstarker Katalysatoren, oder langlebiger Glühbirnen. Ein weiterer Schwerpunkt ist die Aufklärung der komplexen Strukturen von Biomolekülen, beispielsweise von Muskeln oder Ribosomen, den „Proteinfabriken“ lebender Zellen.
Forschungsbeispiel Kunststoffe
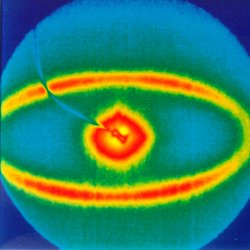
Dünne Fäden aus Kunststoff werden heute zu vielen Gewebearten versponnen: Haltbar, hautfreundlich, atmungsaktiv oder wasserdicht – das Angebot an Synthetikstoffen ist groß. Die feinen Plastikfäden entstehen während eines komplexen Spinnverfahrens: Der Kunststoff wird geschmolzen und durch eine feine Düse gedrückt. Heraus kommt ein Faden, der blitzschnell abgezogen und auf eine Spule gewickelt wird. Seine Festigkeit erhält der Faden beim „Abziehen“: Die Moleküle richten sich in der Kunstfaser aus und kristallisieren teilweise. Um die Prozessbedingungen beim Spinnen der Fäden zu optimieren, nutzen Materialforscher im HASYLAB die Synchrotronstrahlung und die so genannte Kleinwinkelstreuung. Mit ihrer Hilfe können sie beobachten, wie sich die Struktur der Kunstfaser verändert, wenn beispielsweise die Einspritztemperatur gesenkt oder erhöht wird. Die Strahlung aus dem Beschleuniger ist intensiv genug, um Streubilder im Abstand von einigen Sekunden aufzunehmen und Vorgänge zeitlich aufgelöst zu verfolgen - herkömmliche Röntgenröhren brauchen dagegen Stunden oder sogar Tage zur Aufnahme eines einzigen Streubildes.
Mit Synchrotronstrahlung können die Materialforscher auch verfolgen, unter welchen Bedingungen sich Mikrorisse in einem Kunststoff ausbreiten. Informationen darüber, wie, wann und warum sich diese Vorläufer von Bruchstellen bilden, sind von grundlegender Bedeutung, um Kunststoffe zu verbessern und neue Werkstoffe zu entwickeln.
Forschungsbeispiel Schweißnähte
Sicher abheben, Tausende von Kilometern durch die Luft fliegen und sicher wieder am Boden landen – die Bauteile von Flugzeugen müssen viel aushalten. Mögliche Schwachstellen tun sich dort auf, wo nicht alles aus einem Guss ist: an den Verbindungsstellen, den Schweißnähten. An diesen Nähten treten mechanische Spannungen auf. Sind sie zu groß, kann die Schweißnaht brechen. Im HASYLAB kommen daher auch Werkstücke aus dem Flugzeugbau unter die Röntgenlupe. Um die Schweißnähte zu untersuchen, nutzen die Wissenschaftler die besonders intensive Synchrotronstrahlung des Ringbeschleunigers PETRA. Dieser ist achtmal so groß wie DORIS, der üblicherweise für HASYLAB-Messungen genutzte Beschleuniger, und kann Elektronen auf die dreifache Energie bringen. So lässt sich besonders intensive und „harte“ (kurzwellige) Röntgenstrahlung erzeugen. Sie durchdringt problemlos selbst massive Stahlbleche.
Diese kurzwellige Strahlung lenken die Wissenschaftler auf das Werkstück und analysieren, wie das Röntgenlicht vom Material in der Schweißnaht gebeugt wird. Die Ergebnisse der Messungen geben wertvolle Hinweise, welches Schweißverfahren für welche Anwendung am besten geeignet ist.
Forschungsbeispiel Katalysatoren
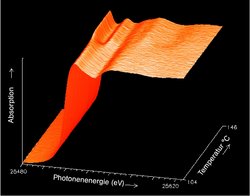
„Ein Katalysator ist ein chemischer Stoff, der die Geschwindigkeit einer chemischen Reaktion erhöht, ohne selbst verbraucht zu werden“, so nüchtern steht es im Lexikon. Doch ohne Katalysatoren kämen zahlreiche technische Verfahren nicht in Gang. Als Katalysator dienen unter anderem spezielle Pulver – winzige Teilchen, die fein verteilt auf einem Träger verankert sind. Der Abgaskatalysator in einem Dieselauto beispielsweise besteht aus einem wabenförmigen Keramikkörper, der eine katalytisch aktive Schicht aus Platin, Vanadium- und Titanoxid trägt. Was bei der Abgasreinigung im „Diesel-Kat“ im atomaren Detail geschieht, zeigt das EXAFS-Verfahren im HASYLAB. Es gibt Aufschluss über die „atomare Nachbarschaft“ einer bestimmten Atomsorte, beispielsweise von Platin. Reagiert dieses Edelmetall im Langzeiteinsatz mit Titan oder Vanadium? Wie verändert sich der Katalysator, wenn er altert? Die Antworten auf solche Fragen werden genutzt, um Katalysatoren noch effektiver und langlebiger zu machen.
In Zusammenarbeit mit Industrieunternehmen werden im HASYLAB verschiedene Katalysatoren untersucht, die beispielsweise in den Bereichen Brennstoffzellen, Abgas-Technologie oder großindustriellen Prozessen eingesetzt werden.
Forschungsbeispiel Glühlampen
Bis auf 3000 Grad Celsius heizt sich der Glühfaden einer handelsüblichen Standard-Glühbirne auf, strahlt dabei Wärme und helles Licht aus und hält etwa 1000 Stunden, ehe er durchbrennt. Glühfäden, die derartigen Belastungen gewachsen sind, bestehen aus Wolfram, dem Metall mit dem höchsten Schmelzpunkt. Im Synchrotronlicht zeigt sich, was in einem Leuchtdraht vor sich geht, wenn die Lampe erstmals richtig glüht: Das metallische Gefüge der Wolframwendel verändert sich grundlegend. Die vielen kleinen Kristallbereiche (Kristallite) im Draht vereinigen sich zu größeren Einheiten; der Glühfaden wird dadurch stabilisiert.
Beobachten lässt sich diese Umkristallisation mit der abbildenden Diffraktometrie, einem speziellen Röntgenverfahren, das HASYLAB-Wissenschaftler entwickelt und patentiert haben. Gemeinsam mit Experten des Glühlampenherstellers OSRAM GmbH untersuchen sie mit dieser Methode, wie sich die Struktur der Wolframwendel beim Glühen verändert. Ihr Ziel: die Vorgänge im Detail zu verstehen, um die Stabilisierung zu optimieren und das Durchbrennen des Glühdrahtes möglichst lange hinauszuzögern. Dies schafft die Voraussetzungen, um den steigenden Anforderungen an die Haltbarkeit der Wolframdrähte gerecht zu werden. Beispiel Auto: Die Lampen im Scheinwerfer sollen möglichst ein Autoleben lang halten und hochfrequente Fahrzeugschwingungen ertragen. Zudem muss der Glühdraht stets genau positioniert sein, um eine gute Straßenausleuchtung zu gewährleisten.
Strukturbiologie
Unverzichtbar ist das intensive Röntgenlicht aus einem Teilchenbeschleuniger, wenn es darum geht, die komplexen Strukturen von Biomolekülen, beispielsweise Proteinen, im Detail aufzuklären. Bei DESY erforschen Wissenschaftler vom Europäischen Laboratorium für Molekularbiologie (EMBL), von der Max-Planck-Gesellschaft (MPG) sowie von anderen Instituten eine Vielzahl von Biomolekülen mit dem Verfahren der Proteinkristallographie.
Das Prinzip ist das gleiche wie bei der Röntgenstrukturanalyse eines Minerals: Ein intensiver Röntgenstrahl wird auf einen Kristall gelenkt, dessen regelmäßig angeordnete Gitterbausteine das Licht in charakteristischer Weise beugen. Aus dem aufgenommenen Beugungsmuster können die Forscher schließen, wie die einzelnen Atome im Kristallgitter angeordnet sind. Allerdings sind Proteine große, normalerweise in Wasser gelöste Moleküle, die sich nur mit Mühe in eine feste Kristallform überführen lassen. Der Lohn dieser Geduldsarbeit: Mit dem Verfahren der Proteinkristallographie lässt sich der Aufbau von großen, kompliziert gebauten Biomolekülen im Detail entschlüsseln - wichtige Informationen, um die biologische Funktion eines Proteins aufzuklären. Für Molekularbiologen ist die Kristallographie ein unverzichtbares Werkzeug, das ihnen beispielsweise hilft herauszufinden, wie Proteine bei der Erschaffung der vielen verschiedenen Zelltypen im menschlichen Körper zusammenwirken oder wie sich neue Medikamente "maßschneidern" lassen.
Forschungsbeispiel Muskeln
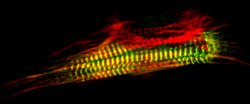
Wenn sich ein Muskel bewegt, wird chemische Energie in mechanische Arbeit umgewandelt. Das Funktionsprinzip im molekularen Maßstab: Bündel aus zwei Sorten von miteinander verzahnten Fäden aus Proteinen, die dicken Myosin- und die dünnen Aktinfilamente, schieben sich ineinander und bewirken so die Muskelbewegung. Die Synchrotronstrahlung ist ein exzellentes Hilfsmittel, um genau zu entschlüsseln, wie diese molekularen Vorgänge ablaufen. Das intensive Röntgenlicht macht die zu dichten Bündeln gepackten Proteinfäden in den Muskelfasern sichtbar. Die molekularen Grundlagen der Muskelbewegung können so mit atomarer Genauigkeit analysiert und verstanden werden.
Das Muskelprotein Titin ist ein besonders großes und daher schwer zu durchschauendes Protein: Mehr als 28.000 Einzelbausteine (Aminosäuren) fügen sich zu einer Kette zusammen, die in sich gefaltet und zu einem Knäuel aufgewunden ist. Diesen Molekülgiganten durchleuchteten Wissenschaftler des Europäischen Laboratoriums für Molekularbiologie (EMBL) mit Synchrotronstrahlung und fanden heraus, dass das gigantische Protein nicht nur ein wichtiges Strukturelement der Muskeln ist, sondern auch eine wesentliche Rolle bei ihrer Bildung spielt. Verantwortlich dafür ist unter anderem eine Kinase, ein biochemischer Katalysator, der dafür sorgt, dass sich die Bausteine der Muskelfasern in der frühen Entwicklung ordnungsgemäß zusammensetzen.
Den EMBL-Forschern ist es gelungen, die Titinkinase zu kristallisieren und ihre atomare Struktur im Röntgenlicht zu entschlüsseln. Auf dieser Basis gelang es auch, ihr genaues Funktionsprinzip zu ermitteln.
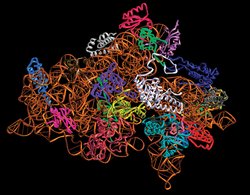
Forschungsbeispiel Ribosomen
Das genetische Alphabet hat nur vier Buchstaben. Aber in ihrer Abfolge ist der gesamte Bauplan des Lebens verschlüsselt. Nach diesem Plan werden die Bausteine des Lebens, die Proteine, zusammengesetzt. Hergestellt werden Proteine in den Ribosomen - speziellen Molekülkomplexen, die in jeder Zelle vorkommen. Wie diese im Detail aussehen, haben Wissenschaftler der Max-Planck-Gesellschaft im intensiven Licht der Synchrotronstrahlung untersucht. Die Analyse gestaltete sich äußerst schwierig, denn ein Ribosom ist enorm groß, sehr biegsam und lässt sich nur schwer in eine feste Kristallform zwängen. Dies aber ist die Voraussetzung, um seinen atomaren Aufbau mit Hilfe des Röntgenlichts aufzuklären. Viele Experten hielten es anfangs für ausgeschlossen, brauchbare Ribosom-Kristalle herzustellen. Den Max-Planck-Forschern ist es dennoch gelungen: Sie konnten im Lichte der Synchrotronstrahlung den Aufbau der komplizierten Ribosomenstruktur mit bisher unerreichter Genauigkeit entschlüsseln. Von dieser biologischen Grundlagenforschung dürften auch die Patienten eines Tages profitieren: Für viele Antibiotika ist das Ribosom der entscheidende Angriffspunkt. Pharmazeuten können wesentlich selektivere und wirkungsvollere Medikamente entwickeln, wenn die „Proteinfabriken“ der Zellen und ihre Funktionsweise im Detail verstanden sind.
DESY gemäß den Bedingungen der Quelle
Quelle: https://www.weltderphysik.de/gebiet/teilchen/licht/synchrotronstrahlung/hasylab/forschung-im-hasylab/