Lebenswissenschaften: Blicke in die Motoren des Lebens
Untersuchungen mit Synchrotronstrahlung ermöglichen einzigartige Einsichten in das komplexe Wechselspiel der Komponenten des Lebens – wie das der Muskeln. Hier können Wissenschaftler untersuchen, wie sich die einzelnen Komponente aufbauen und vernetzen.
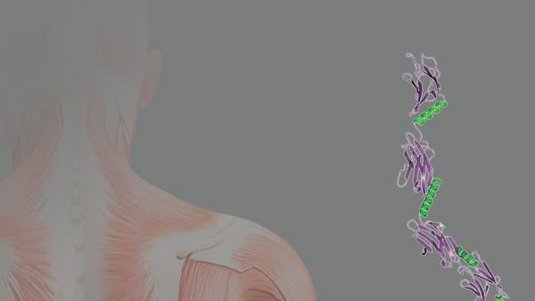
Unter dem Mikroskop gleicht ein Muskel Millionen winziger, in langen Reihen nebeneinander angeordneter Fäden. Diesen sogenannten Sarkomeren verdanken wir Menschen unsere Bewegungsfähigkeit. Es handelt sich um hochkomplexe Strukturen, die an ihren Enden über breite Bänder aus dichtgepackten Molekülen (Z-Scheiben) miteinander verbunden sind. Seit vielen Jahren wird der Aufbau und die Bildung dieser Strukturen untersucht. Insbesondere der Vernetzung der Sarkomere in der Z-Scheibe kommt dabei eine zentrale Bedeutung zu. Wie diese Vernetzungen genau aussehen, war bis jetzt weitgehend unbekannt.
Die Forschergruppen um Matthias Wilmanns, Leiter der Außenstelle des European Molecular Biology Laboratory (EMBL) bei DESY, und Mathias Gautel, einem ehemaligen Mitarbeiter des EMBL, der jetzt am Londoner King's College forscht, haben nun gezeigt, dass Titin, das größte menschliche Protein, beteiligt und in der Z-Scheibe verankert ist. Von dort aus erstreckt sich Titin in seiner vollen Länge über das halbe Sarkomer. Die Arbeiten wurden in Nature veröffentlicht.
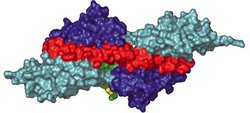
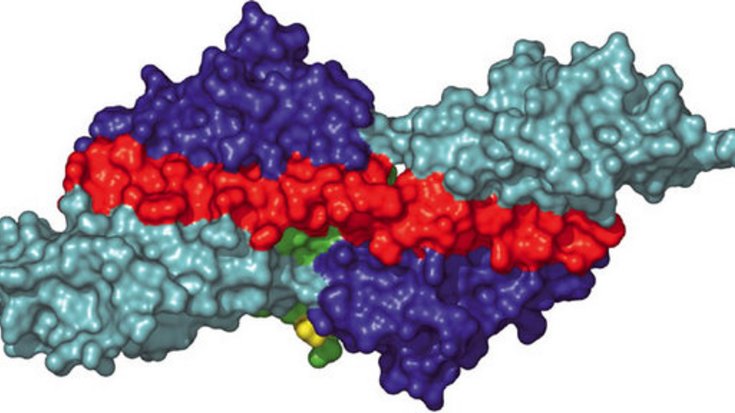
Die jüngste Untersuchung gibt nach mehr als zehn Jahren Forschung eine Antwort auf die Frage nach dem Ablauf des Zusammenbaus. Peijan Zou und Nikos Pinotsis aus Wilmanns Labor ist es gelungen, Teile des Titinmoleküls im Verbund mit einem weiteren Protein namens Telethonin zu kristallisieren. An der EMBL-Außenstelle in Hamburg analysierten sie die Kristalle mit hochenergetischer Röntgenstrahlung. Auf der hochdetaillierten Aufnahme der Verbindungen zwischen den Proteinen entdeckten die Forscher, dass Telethonin die Enden von zwei Titinfäden auf eine Weise miteinander verbindet, die Anhaltspunkte über den Aufbau von Sarkomeren geben kann.
Mit Hilfe moderner Mikroskopiermethoden konnten die Forscher im Labor von Gautel beobachten, wie sich die Moleküle in der lebenden Zelle miteinander verbinden. Es war bekannt, dass Telethonin am Ende des Titin-Moleküls als eine Art „Kappe“ fungiert, nicht jedoch wie es zwei einzelne Proteine zusammenbringt. Die neuen Untersuchungen haben gezeigt, dass Telethonin eine Symmetrie aufweist, durch die es zwei auseinanderstrebende Titin-Moleküle festzuhalten vermag. Das ist etwas Neues. Zuvor wurden bereits andere einzelne Proteine gefunden, die sich als „Palindrome“ an DNA-Moleküle heften können – hier aber wurde erstmals beobachtet, dass Proteine selbst auf diese Weise miteinander verbunden sein können. Aus den Sarkomeren zu beiden Seiten der Z-Scheibe dringen andere Moleküle in das Verbindungsband ein – nach Ansicht der Wissenschaftler könnte ein Teil dieser Verbindungen durchaus dem Muster von Titin und Telethonin folgen. Beide Teams werden nun nach neuen Beispielen dieser Art suchen.
Mit dem Molekülkomplex in seiner endgültigen Zusammensetzung, dem Thema ihrer Forschungsarbeiten, decken die Forscher allerdings lediglich einen minimalen Teil des Muskelproteinriesen Titin ab, das Zehntausende von Aminosäuren beinhaltet. Vermutlich existieren Hunderte oder gar Tausende weiterer Wechselwirkungen. Die Erforschung eines der komplexesten Systeme im Körper des Menschen mit Hilfe der Synchrotronstrahlung hat somit gerade erst begonnen. Diese Arbeit veranschaulicht in eindrucksvoller Weise, wie die moderne biomedizinische Forschung Ansätze aus Zellbiologie, Biophysik und Strukturbiologie miteinander kombiniert. Zudem eröffnet sie neue Wege auf der Suche nach den Zusammenhängen zwischen Krankheiten und bekannten Mutationen im Muskelprotein Titin.
Veröffentlichung
„Palindromic assembly of the giant muscle protein titin in the sarcomeric Z-disk“, P. Zou, N. Pinotsis, S. Lange et al.; Nature, DOI: 10.1038/nature043432006, 2006.
KFS-Studie 2009 gemäß den Bedingungen der Quelle
Quelle: https://www.weltderphysik.de/gebiet/teilchen/licht/forschung-mit-photonen/blicke-in-die-muskeln/