Knallgas setzt Kräfte frei
Roland Wengenmayr
Brennstoffzellen sind in den vergangenen Jahren so sehr in den Mittelpunkt des Interesses gerückt, dass sogar in den Nachrichtensendungen über sie berichtet wird. Führende Automobil- und Energiekonzerne investieren in großem Stil in Brennstoffzellensysteme, kleine Start-up-Firmen werden als Geheimtipps für risikofreudige Kapitalanleger gehandelt. Brennstoffzellen sollen so effizient und umweltfreundlich wie nie zuvor Elektrofahrzeuge, Klein- und Großkraftwerke und sogar tragbare Elektrogeräte wie Laptops oder Handys mit elektrischer Energie versorgen.
Die Berichterstattung in den Medien vermittelt oft den Eindruck, dass diese revolutionäre neue Technologie sich schon bald durchsetzen wird. Tatsächlich sehen inzwischen auch viele Skeptiker eine gute Chance, dass technisch ausgereifte Systeme für die „stationäre“ Energieerzeugung demnächst zu konkurrenzfähigen Preisen auf den Markt kommen. Der „mobile“ Einsatzbereich stellt viel höhere technische Anforderungen an Brennstoffzellen. Brennstoffzellen-Systeme für leistungsfähige Elektrofahrzeuge müssen besonders hohe Leistungsdichten bei niedrigem Gewicht verarbeiten können und zugleich die schnellen Lastwechsel beim Beschleunigen oder Bremsen verkraften. Deshalb liegen die Prognosen von Optimisten und Skeptikern, wann denn die ersten alltagstauglichen Brennstoffzellen- Fahrzeuge Marktreife erlangen werden, heute noch sehr weit auseinander.
Im Prinzip ist eine Brennstoffzelle genial einfach aufgebaut. In der Praxis werden jedoch die Materialien in der Brennstoffzelle zum Teil extremen Belastungen ausgesetzt. In heutigen Prototypen werden viele Materialien eingesetzt, die ursprünglich für ganz andere Anwendungen entwickelt wurden. Sie funktionieren in Brennstoffzellen nicht immer optimal oder verschleißen zu schnell. Deshalb stößt die Entwicklung einer alltagstauglichen und konkurrenzfähigen Brennstoffzellen-Technologie nach wie vor auf Probleme, die nur durch weitere Grundlagenforschung gelöst werden können.
Wissenschaftler der Max-Planck- Gesellschaft beschäftigen sich intensiv mit dieser zukunftsweisenden Technologie. Im Mittelpunkt stehen die „Kinderkrankheiten“ heutiger Brennstoffzellen. Um hier voranzukommen, arbeiten Grundlagenforscher aus Chemie, Materialwissenschaften und Physik eng mit anwendungsorientierten Ingenieuren zusammen. Auch innerhalb der Max-Planck-Gesellschaft gibt es ein Netzwerk von Kooperationen.
Tank und Auspuff notwendig
Brennstoffzellen gehören wie Batterien oder Akkumulatoren zu den „elektrochemischen Zellen“. Solche Zellen haben zwei Elektroden, einen Pluspol (Anode) und einen Minuspol (Kathode), zwischen denen ein elektrischer Strom fließen kann. In der Zelle erzeugt eine chemische Reaktion die elektrische Energie. Batterien sind Einwegspeicher, sie heißen deswegen auch „Primärzellen“.
Brennstoffzellen sind „Tertiärzellen“. Sie können über lange Zeiträume kontinuierlich elektrischen Strom abgeben. Dazu muss allerdings die chemische Reaktion durch die ständige Zufuhr von Sauerstoff und einem Brennstoff aufrechterhalten werden. Eine Brennstoffzelle braucht keine Steckdose, sondern – ebenso wie eine Verbrennungskraftmaschine – einen Brennstofftank und einen Auspuff.
Welche chemische Reaktion läuft in einer Brennstoffzelle ab? Im Prinzip ist es die Reaktion, die im Chemieunterricht als Knallgas-Versuch vorgeführt wird. Wasserstoffgas (H2) und Sauerstoffgas (O2) werden entzündet und reagieren heftig miteinander. Bei der Explosion wird die Reaktionsenergie schlagartig vor allem als Wärme freigesetzt. Das Reaktionsprodukt sind ein paar Tröpfchen Wasser (H2O). In den Gasen H2 und O2 ist mehr chemische Energie gespeichert als in H2O, die Differenz beider Energien wird während der Reaktion frei.
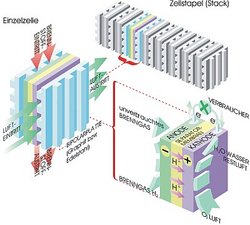
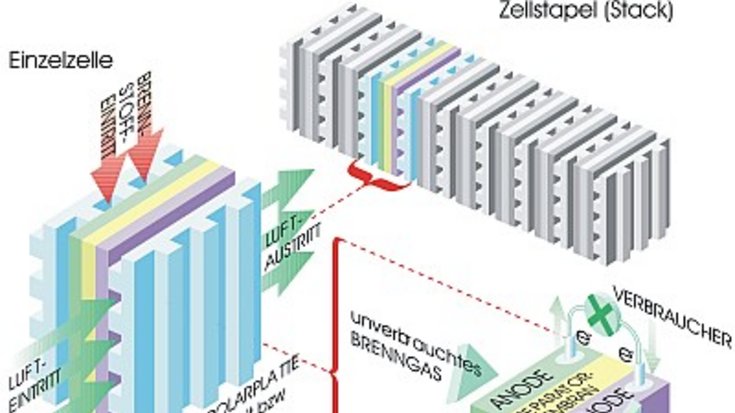
In einer Brennstoffzelle vollzieht sich dieselbe Reaktion „kalt“, also ohne offene Verbrennung. Die Reaktionsenergie wird zum großen Teil in technisch nutzbare elektrische Energie umgesetzt. Um das zu erreichen, ist die Brennstoffzelle so konstruiert, dass die Reaktion in zwei Teilreaktionen separiert wird. Sie laufen räumlich voneinander getrennt entweder an der Anode oder an der Kathode ab. In der Abbildung ist eine Membran-Brennstoffzelle (PEMFC) schematisch dargestellt. In ihr trennt eine teildurchlässige Membran, der „Separator“, den Anodenraum von dem Kathodenraum. Die beiden Elektroden sind porös, damit das Brenngas und die Luft einströmen und die Abluft zusammen mit dem Reaktionsprodukt wieder ausströmen kann. Die Oberflächen der porösen Elektroden sind mit Katalysatoren aus Platin oder Edelmetall-Legierungen beschichtet. Katalysatoren beschleunigen die chemischen Reaktionen und machen die Brennstoffzellen erst funktionsfähig.
Sauerstoffatome nehmen Elektronen auf
An der Anode wird das H2-Molekül oxidiert. Es wird in seine zwei H-Atome zerlegt, die dann ihre Elektronen abgeben. Sie bestehen schließlich nur noch aus dem positiv geladenen Kern, dem Proton. An der Kathode wird O2 ebenfalls in seine zwei Atome zerlegt. Dann werden die O-Atome reduziert, das heißt: Jedes O-Atom nimmt je zwei Elektronen auf und verwandelt sich in ein negativ geladenes Sauerstoffion. Damit die gesamte Reaktion bis hin zum Endprodukt Wasser vollständig ablaufen kann, müssen die Elektronen und die Protonen von der Anodenseite zur Kathodenseite fließen.
Die Brennstoffzelle stellt dafür zwei getrennte Wege zur Verfügung. Wird ein externer Verbraucher – etwa ein Elektromotor – angeschlossen, so können die Elektronen über diesen von der Anode zur Kathode fließen. Dabei transportieren sie die Energie der chemischen Reaktion vom Inneren der Zelle zum Verbraucher, wo sie in Nutzarbeit umgewandelt wird. Die Separator-Membran der Membran-Brennstoffzelle lässt nur Protonen passieren, aber keine Elektronen. Die Protonen fließen zur Kathodenseite und verbinden sich dort mit den Sauerstoffionen zum Endprodukt Wasser. Die gesamte Reaktion liefert eine elektrische Spannung von 1,23 Volt. In der Praxis liegt die Betriebsspannung, die eine einzelne Brennstoffzelle erreicht, etwas niedriger. Zum Vergleich: Eine handelsübliche Nickel-Cadmium-Zelle erreicht knapp 1,2 Volt Betriebsspannung.
Um höhere Betriebsspannungen zu erzeugen, werden einzelne Brennstoffzellen zu einem Zellstapel zusammengeschaltet. Im Englischen bezeichnet man diesen als „Stack“. Das Prinzip der Zusammenschaltung wird übrigens bei allen Batterien und Akkumulatoren angewandt, die höhere Betriebsspannungen erreichen müssen. Denn alle elektrochemischen Zellen, die technisch verwendet werden, erreichen nur Betriebsspannungen von 1 bis 1,2 Volt.
Die Fachleute unterscheiden zwischen Nieder-, Mittel- und Hochtemperatur- Brennstoffzellen. Membran-Brennstoffzellen arbeiten bei niedrigen Drücken bis maximal fünf Bar und bei Temperaturen bis maximal 150 Grad Celsius. Sie gehören damit zu den Niedertemperatur-Brennstoffzellen. Hochtemperatur-Brennstoffzellen haben Betriebstemperaturen bis 1000 Grad Celsius. Sie sind vor allem für stationäre Kraftwerke interessant.
Welt der Physik
Quelle: https://www.weltderphysik.de/gebiet/technik/energie/brennstoffzellen/knallgas/