Was Pest-Bakterien so gefährlich macht
Stochastische Optische Rekonstruktionsmikroskopie zeigt: Auf Toxine des Pesterregers reagieren Immunzellen deutlich anders als auf etwa die von E. coli
Baltimore (USA) - Warum die Pest um einiges bedrohlicher ist als eine Infektion mit vielen anderen Bakterien, darauf konnten amerikanische Forscher dank besonders hochauflösender Mikroskopiertechnik eine mögliche Antwort finden. Das menschliche Immunsystem reagiert auf unterschiedliche Weise auf die Giftstoffe verschiedener Erreger: Während sich bei Kontakt mit dem Toxin von Escherichia coli Konzentration und Anordnung bestimmter Proteine in der Membran von Immunzellen verändern, geschieht dies beim Kontakt mit dem Toxin von Yersinia pestis, dem Erreger der Pest, nicht. Beobachten konnten die Wissenschaftler dies mithilfe der so genannten Stochastischen Optischen Rekonstruktionsmikroskopie (STORM), bei der Moleküle in lebenden Immunzellen abgebildet werden können. Sie präsentierten die Details auf dem Jahrestreffen der Biophysical Society in Baltimore. Mithilfe dieser Methode ist es möglich, Details jenseits der so genannten Beugungsgrenze sichtbar zu machen. Diese Grenze der Auflösung, die mit herkömmlicher Mikroskopie machbar ist, entspricht der Hälfte der Wellenlänge des verwendeten Lichts.
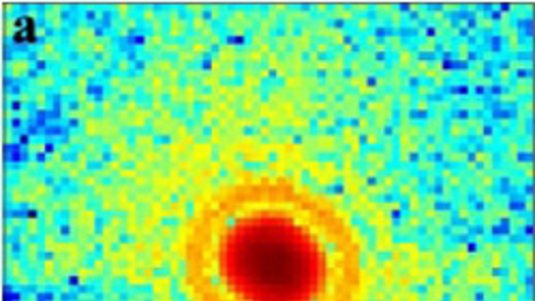
"Es ist eine Möglichkeit, biologische Proben in Auflösungen abzubilden, von denen man früher dachte, dass sie unerreichbar sind", erläutert Jesse Aaron von den Sandia National Laboratories in Albuquerque. Aaron und seine Kollegen konnten die Organisation eines Schlüsselproteins auf der Außenhülle von Immunzellen darstellen, welche bestimmte toxische Substanzen erkennen, die von Bakterien freigesetzt werden. Diese Rezeptorproteine sind ein zentrales Element der frühen angeborenen Immunabwehr. Solche Organisations-Prozesse finden weit jenseits der Beugungsgrenze statt, von der klassischerweise angenommen wurde, dass sie das absolute Limit des Darstellbaren ist. "Bis die superauflösenden Methoden entdeckt wurden, gab es auch tatsächlich keine Möglichkeit, diese Interaktionen sichtbar zu machen", sagt Aarons Kollegin Jerilyn Timlin.
Den Forschern gelang es nun abzubilden, wie sich so genannte TLR4-Rezeptoren organisieren, wenn sie auf toxische Lipopolysaccharide verschiedener Bakterien treffen. Machen sie etwa von E. coli produzierte Toxine aus, erhöht sich ihre Zahl und sie sammeln sich auf der Zellmembran. Diese Veränderungen kommen allerdings nicht vor, wenn die Rezeptoren in Kontakt mit Toxinen von Y. pestis kommen. Damit liefern die Beobachtungen Hinweise darauf, warum das menschliche Immunsystem manche Erreger wie zum Beispiel E. coli zumeist mühelos abwehrt, andere Erreger wie etwa Y. pestis dagegen in der Lage scheinen, das Immunsystem zu umgehen. Die Arbeit liefert erstmals direkte Beweise für diese Unterschiede in molekularen Veränderungen, die bislang mit herkömmlichen bildgebenden Verfahren nicht darzustellen waren.
Wissenschaft aktuell
Quelle: https://www.weltderphysik.de/gebiet/leben/nachrichten/2011/was-pest-bakterien-so-gefaehrlich-macht/