Proteine und Viren im Blick des Röntgenlasers
Intensive Lichtpulse entschlüsseln innere, dreidimensionale Struktur von Proteinen und Nanokristallen - Nutzen für Entwicklung neuer Arzneien und der künstlichen Photosynthese
Hamburg/Menlo Park (USA) - Nur für einen millonstel Bruchteil einer milliardstel Sekunde strahlten die Röntgenblitze auf Viren und Nanokristalle. Doch diese extrem kurze Zeitspanne reichte aus, um genug Daten für ein dreidimensionales Strukturbild der filigranen Proben zu sammeln. Deutsche, schwedische und amerikanische Physiker präsentieren nun in der Zeitschrift "Nature" die ersten Bilder von Proteinen und Viren, die mit dem Röntgenlaser der Linac Coherent Light Source in Menlo Park aufgenommen wurden. Mit den detailreichen Einblicken könnten in Zukunft schneller neue Wirkstoffe entwickelt und das Geheimnis der Photosynthese auf atomarer Ebene gelüftet werden.
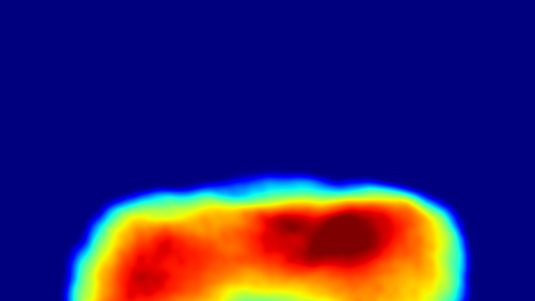
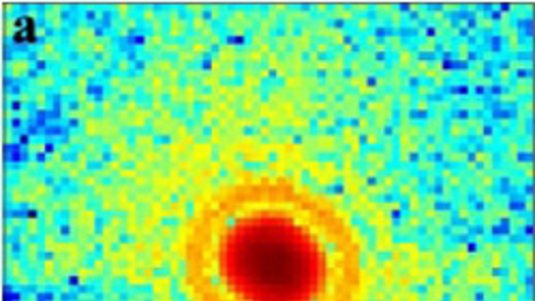
"Diese Experimente sind ein Durchbruch auf unserem Weg zur Röntgenbeugung von Einzelobjekten", sagt Helmut Dosch, Leiter des Forschungszentrums DESY in Hamburg, wo schon vor über zehn Jahren die ersten Grundlagen für die intensiven Röntgenlaser gelegt wurden. Der in enger Zusammenarbeit mit den Hamburgern entwickelte "Freie Elektronen Laser" am SLAC National Accelerator Laboratory nahm nun sowohl einzelne Viren und winzige Nanokristalle aus Proteinen in sein Visier. Die auftreffenden, kurzen Röntgenblitze wurden von diesen Objekten reflektiert und lieferten ein facettenreiches Beugungsmuster. Pro Minute konnten die Forscher bis zu 1800 solcher Muster aufzeichnen. Durch die geschickte Auswahl von einigen tausenden dieser Datensätze entstanden die hochaufgelösten Strukturbilder, die den atomaren Aufbau von Viren und Proteinen in allen drei Raumdimensionen offenbarten.
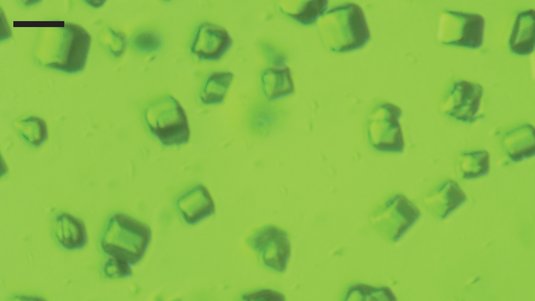
Zwar können ähnliche Kristallstrukturen bereits seit vielen Jahren mit der fokussierten Röntgenstrahlung aus Synchrotronringen sichtbar gemacht werden. Doch zeigt sich die Vorbereitung der Proben in Einkristallen immer wieder als große Herausforderung für die Wissenschaftler. Mit der nun um ein Vielfaches intensiveren Strahlung der Röntgenlaser sind diese Detaileinblicke deutlich einfacher und schneller möglich. So genügte es beispielsweise, viele Nanokristalle von Membranproteinen in einem engen Strahl mit dem Röntgenblitzen zu kreuzen. Bevor diese durch die intensive Strahlung zerstört wurden, konnte das an der Kristallstruktur gebeugte Röntgenlicht mit empfindlichen Detektoren aufgefangen werden.
Als ein erstes Testobjekt wählten die Forscher das so genannte "Photosystem I", ein Membranprotein, das bei der Photosynthese von Grünpflanzen eine wichtige Rolle spielt. Die neuen Detailbilder sollen nun zu einem besseren Verständnis dieser natürlichen Wandlung von Sonnenlicht in nutzbare Energieformen wie Zucker führen und den Weg zu einer künstlichen Photosynthese ebnen. "Diese Ergebnisse sind der Höhepunkt langjähriger Arbeit, die hier bei DESY mit Experimenten an FLASH, dem Freie-Elektronen Laser in Hamburg, ihren Anfang nahmen", sagt Henry Chapman, Erstautor der aktuellen Studie.
In Zukunft werden nicht nur die Amerikaner über einen vielseitig nutzbaren Röntgenlaser verfügen. Denn am DESY-Forschungszentrum in Hamburg entsteht derzeit der 3,4 Kilometer lange "European XFEL". Ab 2014 werden hier in einem Tunnel die extrem intensiven Röntgenblitze erzeugt und auf eine Vielzahl von Proben gelenkt werden. "Wir schauen in die Welt von morgen, in der wir Aufnahmen von nicht-kristallinem Material mit Röntgenlasern in den Griff bekommen werden", ist DESY-Direktor Dosch überzeugt.
Wissenschaft aktuell
Quelle: https://www.weltderphysik.de/gebiet/leben/nachrichten/2011/proteine-und-viren-im-blick-des-roentgenlasers/